Az izolált mikroszómákkal végzett vizsgálatoknak köszönhetően az első, még a 70-es évek elején felfedezett, fehérje-lokalizációt meghatározó szignál éppen az ER-be irányító szekvencia volt. Az ER-jel a fehérjék N-terminálisán található 16-30 aminosavból álló szakasz. A pontos összetétel változó, inkább az aminosavak tulajdonsága és helyzete meghatározó: 1-2 pozitív töltésűt közvetlenül 6-15 hidrofób aminosav követ, és ez a hidrofób „mag” elengedhetetlen a jel felismeréséhez (1. ábra).

1. ábra Az endoplazmatikus retikulum (ER) lumenébe irányító jel és receptora. A „színkód” megfelel a 2., 3. és 4. ábrákon alkalmazottnak. A: Az ER-lokalizációs szignál a fehérje N-terminálisán található, 1-2 pozitív töltésű aminosavat követő hidrofób szakaszból áll. A rajzon az ER membránjában lokalizálódó peptidáz (lásd . ábra) hasítási helye is látható. B: , Az SRP (signal recognition particle) szerkezete és doménjei: halványlilával az RNS, pinkkel a fehérjealkotók vannak feltüntetve.
Az ER-szignál szükséges és elégséges a fehérje transzportjához: hiányában egy szekréciós fehérje a citoszolban marad, ha pedig mesterségesen egy normálisan máshol működő fehérje N-terminálisába építik, elérhető, hogy az az ER lumenébe kerüljön. A kísérletek során az is kiderült, hogy a fehérjék teljes szintéziséhez szükséges a mikroszómák jelenléte; sőt, a transzláció az első kb. 70 aminosavnyi fehérjerészlet szintézise után a mikroszómák felszínén folytatódik, egyenesen a belső térbe (valójában ekkor még csak körülbelül az első 30-40 aminosav érhető el a készülő fehérjéből a citoszol felől, a többi a nagy alegység csatornájában van). Mikroszómák nélkül, szabad riboszómákon ugyan elkészül a fehérje, de utólag már sohasem juthat be a lumenbe. Ezért ezt a folyamatot kotranszlációs transzlokációnak nevezték el. A vizsgálatok során az is kiderült, hogy a szabad riboszómákon kialakult, a mikroszómákon kívül rekedt fehérjével szemben a lumenbe jutottak rövidebbek, éppen a szignál hasítódik le róluk.
A fentebb bemutatott sejtmentes transzport-rendszer segítségével az ER-be vezető útvonal többi komponensét is sikerült izolálni. Bár a transzláció, mint minden esetben, szabad riboszómán kezdődik, az N-terminális szignált az élő sejtben még a fehérje szintézisének legelején (amint a szignál kijutott a riboszóma felszínére) felismeri specifikus receptora. Ez a szolubilis receptor az SRP (signal recognition particle) ribonukleoprotein, amely egy 300 nukleotidnyi RNS „vázra” kötődött hat fehérjéből áll. Az ER-szignál egy hidrofób zsebbe illeszkedik, az SRP egy másik doménje pedig akadályozza a további transzlációt, mert az elongációs faktor helyére köt be (1. és 2. ábra). Így a további fehérjeszintézis mindaddig igen lassú, míg az SRP nem kötődik az ER membránjában található, két alegységből álló SRP-receptorhoz. Ez nagyon „praktikus” lépés, mert dajkafehérjék nélkül is megakadályozza, hogy a fehérje frissen szintetizálódó N-terminálisa a transzlokációt gátló kompaktabb térszerkezetet vegyen fel (emlékeztetőül: a mitokondriumba jutó fehérjék csak chaperonok segítségével tudják megőrizni „kitekeredett” szerkezetüket – lásd 7. fejezet). A riboszómához csatlakozott SRP és receptorának kölcsönhatása akkor igazán tartós, ha mind az SRP (egyik fehérjekomponense révén), mind az SRP-receptor GTP-kötött állapotban van.
Az SRP és az SRP-receptor interakciója egyrészt pozicionálja a riboszómát az ER felszínére, másrészt lehetővé teszi a transzláció folytatását. Ugyanakkor kötődésük hatására hatékonyan hidrolizálják GTP-jüket, és ez az a lépés, amely lehetővé az SRP leválását a riboszómáról és a receptorról (2. ábra).

2. ábra Az ER-szignált tartalmazó fehérje útja az ER lumenébe. Az SRP a citoszolban kötődik az általa felismert hidrofób szekvenciához, megállítja a transzlációt és az ER citoszolikus felszínén található membránreceptorhoz kötődik. Mind a receptor, mind az SRP hidrolizálja GTP-jét és elválnak egymástól; eközben a riboszóma illeszkedik a csatornára (transzlokon). A szintézis folytatódik, az N-terminális szignál levágódik, végül a fehérje a lumenbe kerül.
A szabaddá vált partnerek ezután elengedik a GDP-t, és a citoplazmában jóval nagyobb koncentrációban lévő GTP-t kötve alkalmassá válnak egy újabb ciklusra. A transzlokációt biztosító energiaforrás egyik eleme tehát a GTP-hidrolízis.
Egyenlőre még nem tisztázott módon, de az SRP leválása hozzájárul ahhoz is, hogy a riboszóma nagy alegységének megfelelő illeszkedésével a születő fehérje N-terminálisa a közeli transzlokonba hatoljon, amelyet a transzlokon és a riboszóma kapcsolódásának stabilizálódása követ. A folytatódó transzláció során születő új peptidlánc ezek után már a csatorna belsejében, N-terminálisával az ER lumene felé halad tovább.
Az N-terminális jel, az SRP és az SRP receptora olyannyira konzervált, hogy a prokariótákban is működik: ott a sejthártyába irányított membránfehérjék kotranszlációs transzportját biztosítja. Kölcsönhatásaik részleteit elsősorban a bakteriális homológok tanulmányozásával ismerték meg.
Ahogyan a citoszolban zajló transzlációs folyamat, úgy az ER-kötött fehérjeszintézis is történhet poliriboszómákon. Az átíródó mRNS végig az ER felszínén lokalizálódik, de pozíciója folyamatosan változik. Az egymás közelében lévő transzlokonokon elhelyezkedő riboszómák között adódik „kézről kézre”, mint egy futószalag. Amint az egyik riboszóma elkészítette a fehérjét, alegységeire szerelődik szét, és a citoszolba visszajut. Az mRNS leolvasott 5’ végét viszont újabb szabad riboszómák foglalják el, az átírt szignál hatására az ER-re kerülnek. Természetesen a többi, ugyanazon mRNS-en dolgozó riboszóma közelébe, hiszen az mRNS, mint egy kötél, fogva tartja őket (3. ábra).

3. ábra A kotranszlációs transzlokáció lépései.. Az ER-fehérjék szintézise is történhet az ER felszínéhez kötődő poliriboszómákon (az ábrán az SRP és receptora nincs feltüntetve). A hidrofób N-terminális szignál jelenléte szükséges a csatornát elzáró peptidrészlet, a „dugó” félrecsúszásához, amely a transzláció végén, a fehérjelánc távozta után visszakerül eredeti helyére. A csatornakomplexhez csatlakozik a membránban lokalizálódó szignál-peptidáz, amely még a transzlokon területén lehasítja az N-terminális jelet. A levágott szignál a membránban degradálódik.
Kotranszlációs transzlokáció: A fehérjék útja az ER-ig (animáció)
Az ER-be irányuló fehérjetranszportot biztosító csatorna szerkezetét sok évig tartó vizsgálat tárta fel. Az első eredmények olyan élesztőmutánsokkal folytatott kísérletek során születtek, amelyekben a szekréciós fehérjéket szintetizáló riboszómák az ER felszínéig még eljutottak, ám ott elakadt a további transzláció. Az így azonosított, az evolúció során erősen konzervált csatornafehérjét az élesztőmutáns után a szakirodalomban azóta is Sec61α-nak, a három tagból (Sec61α, Sec61β és Sec61γ) álló teljes komplexet, a transzlokont pedig Sec61 komplexnek nevezik. A csatorna belsejében lévő vizes pórust a Sec61α alakítja ki membránon átívelő doménjei által.
Csakúgy, mint a szignál felismerésére és ER-hez szállításához szükséges apparátus, a csatornát képező fehérjék is erősen konzerváltak. Prokariótákban a sejten kívülre irányuló fehérjeexportban és a membránfehérjék integrálásában játszanak szerepet. Sok strukturális modell készült a Sec61 transzlokonról, de a csatorna molekuláris szerkezetét legpontosabban feltáró röntgen-krisztallográfiás vizsgálat ezideig csak egy archebaktériumból izolált homológ esetében sikerült. A kapott adatok alapján maga a pórus körülbelül 1 nm átmérőjű, ezért csak teljesen kitekeredett fehérjelánc képes áthaladni rajta. Ugyanakkor kis molekulák bőven átjuthatnának, ami persze sértené az ER belső terének integritását. A csatorna zártságát egy rövid, helikális szerkezetű peptid, ”dugó” biztosítja, amely az N-terminális szignál-szekvenciát érzékelve konformációs változáson esik át, és átengedi a növekvő polipeptidláncot. Amint a transzláció befejeződött, a fehérjedugó visszaveszi eredeti pozícióját, és teljesen elzárja a pórus belsejét (3. ábra). A pórusnak azonban nyitott állapotban is biztosítania kell azt, hogy az áthaladó fehérjelánc mellett ne szökhessenek ki vagy be kis molekulák, ionok. A transzlokon középső területén, a Sec61 hélixeinek a pórus belseje felé néző oldalát sok hidrofób izoleucin oldallánc alkotja. Ezek rugalmas tömítőgyűrűként viselkednek: az átcsúszó peptid átfér, de az egyéb hidrofil molekulák nem jutnak át rajta.
Ahogy az már a korai kísérletekből is kiderült, az ER-be irányító jel nincs rajta a transzlokonon átjutott érett fehérjén. Eltávolításáról az úgynevezett szignál-peptidáz gondoskodik, amely a transzlokonhoz asszociálódó transzmembrán fehérje. A Sec61 komplex finomszerkezete azt mutatja, hogy a csatorna képes oldalirányban, a lipidmembrán felé is megnyílni. Ezt a lépést minden bizonnyal az ER-szignál hidrofób szekvenciája váltja ki. Így a szintetizálódó fehérje eredeti N-terminálisa kicsusszan a lipidrétegbe, ahol a szignál-peptidáz levágja, majd egyéb proteázok által degradálódik. A transzláció zajlik tovább, és az ily módon felszabadult új N-terminális vég folytathatja útját az ER ürege felé (3. ábra).
A mikroszómákkal végzett in vitro kísérletek alapján magához a póruson való átjutáshoz elegendő a fehérje szintéziséhez felhasznált energia. A riboszóma felől folyamatosan növekvő peptidlánc így magától „beletolódik” a csatornába.
A Sec61 transzlokon (animáció)
Átjutás a csatornán (animáció)
Megemlítjük, hogy elsősorban élesztőkben létezik poszttranszlációs transzlokáció is, melynek során kész fehérjék is bejuthatnak az ER-be. Ezek a fehérjék azonban, ahogy ez a mitokondriumok és kloroplasztiszok poszttranszlációs transzportjára is jellemző (lásd 7. fejezet), nem veszik fel végső szerkezetüket, citoszolikus dajkafehérjék tartják őket széttekert állapotban. A mechanizmus nem igényel SRP-t és SRP-receptort, a szignál-szekvenciát az ER membránjában lokalizálódó heterotrimer Sec62 komplex ismeri fel, majd továbbítja ugyanahhoz a Sec61 transzlokonhoz, amely a kotranszlációs transzlokációt is biztosítja. Magában az átjutásban szerepet játszik egy Sec63 nevű transzmembrán komplex, valamint a lumenben található dajkafehérjék, elsősorban a Hsp70 fehérjék családjába tartozó BiP (Binding immunoglobulin protein) chaperonok (ezekről még később lesz szó). Ahogy arról a mitokondriális fehérjetranszport során szintén szó esik, ezek a dajkafehérjék ATP felhasználásával húzzák be a fehérjét az ER lumenébe. Pontosabban: bár a fehérje random módon ki-becsúszkálna a pórusban, a BiP chaperonok racsni módjára nem engedik a visszajutást, így végeredményben a nettó elmozdulás befelé irányul (4. ábra).

4. ábra A poszttranszlációs transzlokáció mechanizmusa. A citoszolban elkészült fehérjét chaperonok (az ábrán nincsenek feltüntetve) szállítják a Sec61 komplex közelében lokalizálódó Sec62/Sec63 komplexhez, amely mind az N-terminális szignál felismeréséhez, mind az átjutáshoz szükséges. A transzlokációban fontos szerepet játszanak az ATP felhasználásával működő BiP-chaperonok is.
Ma azt is feltételezik, hogy kis mértékben, de az emlősök sejtjeiben is szerepet játszik a poszttranszlációs transzlokáció, elsősorban a kisméretű, 75 aminosavnál rövidebb szekréciós fehérjék esetében. Ezek ugyanis túl rövidek lennének ahhoz, hogy még szintézisük folyamán a SRP kötődéséhez szükséges teljes szignál kibukkanjon a nagy alegység csatornájából, mielőtt befejeződne a transzláció.
Elképzelhető, hogy az ATP-hidrolízisből energiát nyerve, „molekuláris racsniként” működő BiP chaperonok a kotranszlációs transzlokáció utolsó szakaszában is szerepet kapnak. Ugyanis a szintézis befejeztével a riboszóma leválik az ER-ről, így természetesen már nem tudja a fehérje néhányszor tíz aminosavnyi utolsó szakaszát beletolni a csatornába. A BiP chaperonok a feltételezések szerint itt is a peptidlánc C-terminálisának véletlenszerű ide-oda csúszkálásait „egyirányúsítják” a lumen felé, ezáltal jócskán meggyorsítják az előbb-utóbb egyébként ATP nélkül is bekövetkező teljes átjutást (emlékeztetőül: in vitro kísérletek alapján a kotranszlációs transzlokációt biztosítja a riboszóma működése és az SRP reciklizációjához szükséges GTP).
Poszttranszlációs transzlokáció eukariótákban (animáció)
Ahogyan azt már a bevezetőben is említettük, a teljes endomembrán rendszer és a sejthártya valamennyi membránfehérjéje az ER felszínén szintetizálódik. Emellett a membránfehérje irányultsága – azaz melyik része néz a citoszol felé, és melyik a membrán másik felszínének irányába - a szintézis után már sohasem változhat meg. Bármilyen sok vezikula-lefűződés és -fúzió után is jut el például a plazmamembránig, az eredetileg ER-lumen felé néző része mindig az extracelluláris térbe lóg majd. A membránban elfoglalt helyzet nincs kódolva az aminosavsorrendben, kizárólag az határozza meg, hogy a beépülés a citoszol irányából valósul meg.
A membránfehérjék szintézise az előző bekezdésben ismertetett lépésekkel kezdődik, ugyanazon SRP és SRP-receptor segítségével kerül a riboszóma az ER felszínére, a transzlokáció ugyanazon Sec61 transzlokonon keresztül zajlik. Sőt, van olyan membránfehérje, amelyet a szolubilis fehérjékkel kapcsolatban megismert N-terminális szignál irányít az ER-hez. Többségük esetében azonban az SRP számára jelként az a belső, 20-25 aminosavból álló hidrofób szekvencia szolgál, ami nem más, mint maga az (N-terminálistól számított) első leendő transzmembrán domén. Ezek a domének α-helikális szerkezetűek, és a foszfolipid kettős réteg hidrofób belső részét ívelik át. A membránfehérjéket topológiai csoportokba sorolják, aszerint, hogy hány transzmembrán doménből állnak, és azok hogyan orientálódnak a két felszín között (5. ábra).

5. ábra A membránfehérjék osztályozása orientációjuk és transzmembrán doménjeik száma alapján.
Az első három csoportot az egyetlen transzmembrán doménből álló fehérjék alkotják. Az I. típus ugyanazt a levágódó N-terminális jelet hordozza, mint a lumenbe jutó vízoldékony fehérjék, transzlokációja is teljesen azonos módon zajlik. Ebben az esetben viszont amint a fehérje belsejében lévő hidrofób szekvencia áthalad a Sec61 komplex pórusán, a transzlokon oldalsó, a lipidrétegbe vezető „kapuja” kinyílik, ugyanúgy, ahogyan egyszer már korábban a levágódó N-terminális szignál hatására. A transzmembrán domén azonban nem vágódik le, rögzíti a fehérjét, a transzlokáció itt megakad – az ilyen jellegű szekvenciát ezért „stop-transzfer” szekvenciának is hívják. A citoszol felől a riboszóma ugyanakkor tovább folytatja a szintézist, mindaddig, míg a stop-kodonhoz nem ér. Ily módon a kész fehérje a membránba integrálódott, úgy, hogy N-terminálisa (amelyről már levágódott az eredeti szignál) a lumen felé, míg C-terminálisa a citoszol felé néz (6. ábra).

6. ábra Az I. típusú transzmembrán fehérjék kialakulása. A halványabb szín az adott részlet korábbi, míg a sötétebb árnyalat a későbbi helyzetét, a piros nyilak pedig a mozgás irányát jelölik. (1.) Az I típusú transzmembrán fehérjék a szolubilis fehérjékkel megegyező N-terminális hidrofób ER-szignált hordozzák, amely a transzlokáció kezdetén a csatorna laterális megnyílásával a membránba ékelődik. Orientációját valószínűleg meghatározzák a szignál N-terminális végén található pozitív töltésű aminosavak. (2.) A fehérje tartalmaz egy következő hidrofób szakaszt is, amely a csatorna területén szintén a membránba inszertálódik, így a további transzlokációt megakadályozza („stop-transzfer” szignál). Az N-terminális szignált levágja a szignál-peptidáz. (3.) A transzláció azonban folytatódik, majd a termináció bekövetkeztével a riboszóma leválik az ER felszínéről, és a transzmembrán fehérje C-terminálisa a citoszol felé néz.
Az I. típusú transzmembrán fehérjék tipikus képviselői a tirozin kináz receptorok.
A II. és III. típusú transzmembrán fehérjék esetében már nem találunk levágódó N-terminális jelet. Mindkét típusnál egyetlen hidrofób belső domén az, amit szintézise után az SRP azonnal felismer és a riboszómát az ER-hez szállítja. A két kategória között az a különbség, hogy míg a II. típusú fehérje C-terminális vége az ER lumenében van, a III. típusnál a citoszolban (az I. típussal megegyezően). Vajon mi határozza meg, hogy hogyan helyezkedik el a membránban a fehérje? Bár orientációja transzmembrán doménjének irányultságától függ, magában a döntésben a hidrofób szakasz szekvenciája nem játszik szerepet.
Felfedezték, hogy a hidrofób szakaszt valamelyik végén mindig bázikus aminosavak csoportja határolja, erős pozitív töltést biztosítva vagy N-terminális szélén (a II. típusú fehérjék esetében), vagy C-terminális szélén (a III. típusú fehérjék esetében). Amikor a riboszóma dokkol a transzlokonon, a jelként szolgáló, majd a csatornába ékelődő hidrofób szakasz mindig úgy helyezkedik el, hogy a pozitív töltésű rész a citoszol felé irányul. Ezt sokáig nem tudták megmagyarázni, de a legújabb eredmények szerint ennek az az oka, hogy maga a Sec61 komplex (citoszolikus felén csoportosuló negatív töltésű aminosavjai révén) irányítja a hidrofób szakasz orientációját. Ez minden bizonnyal szerepet játszik a lumenbe tartó fehérjék levágódó szignáljának elhelyezkedésében is (lásd 3. és 6. ábra).
A II. típusú fehérjéknél tehát a már korábban transzlálódott N-terminális lánc sohasem jut be az ER-be, hanem kívül marad a citoszolban. A hidrofób szakasz a csatorna oldalsó nyílásán a lipidrétegbe jut és rögzíti a leendő fehérjét. A transzlokonra települt riboszóma azonban tovább folytatja a szintézist, és az újonnan elkészült fehérjelánc – a transzmembrán domén elhelyezkedése miatt – a lumenbe csúszik bele, mindaddig, míg a legutolsó (C-terminális) aminosav is el nem készült. Miután a transzmembrán régió orientációja lehetővé teszi, hogy a növekvő peptidlánc a lumenbe jusson, „start-transzfer” szekvenciának is nevezik (7. ábra).

7. ábra A II. és III. típusú transzmembrán fehérjék ellentétes orientációját az határozza meg, hogy hidrofób szignáljuknak melyik végén lokalizálódik erős pozitív töltés. A szignál elhelyezkedése a II. típus esetében lehetővé teszi a transzláció során képződő fehérjelánc átjutását a csatornán („start-transzfer” szignál). A III. típusú fehérjéknél a hidrofób szakasz megakasztja a fehérjelánc további transzlokációját („stop-transzfer” szignál), a növekedés a citoszol irányába folytatódhat.
Ebbe a kategóriába tartozik például a transzferrin receptor.
A III. típusú fehérjék esetében, ahogy fentebb említettük, a pozitív töltések a hidrofób szakasz C-terminális határán vannak, és a citoszol irányába orientálják azt. Ezért a már elkészült N-terminálisnak kell a lumen felé néznie. Ehhez a kész peptidláncnak át kell préselődnie a csatornán. Az ilyen típusú fehérjéknél ez a szakasz ezért is rövid – vagy másképp fogalmazva: a hidrofób transzmembrán domén az N-terminális közelében van. A transzlokonon ülő riboszóma ebben az esetben is folytatja a transzlációt, de a készülő peptidlánc és végül az elkészült C-terminális vég már a citoszolba kerül (7. ábra). Ismert III. típusú fehérje a citokróm P450.
Figyeljük meg, hogy bár az I. és III. típusú transzmembrán fehérjék orientációja megegyezik, ez eltérő transzlokációs mechanizmussal alakult így. Jellegzetes az is, hogy emiatt az I. típussal szemben a III. típus N-terminális lumenbe érő vége mindig rövid. Külön csoportba sorolásuk ezért mindenképpen indokolt.
Bár talán első ránézésre jóval bonyolultabbnak tűnhet a membránon többször átnyúló fehérjék szerkezetének kialakulása, ha a fenti bekezdésben foglaltakat sikerült megérteni, ezután sokkal könnyebb dolgunk lesz. Az ER-hez irányító szignálként itt is egy hidrofób szakasz, egy leendő transzmembrán domén szolgál. Mégpedig az N-terminális véghez legközelebb eső, hiszen ez bukkan fel először a riboszóma nagy alegységének csatornájából, ezt ismeri fel az SRP. Az orientációt is ez a legelső hidrofób régió, pontosabban az azt határoló pozitív töltések elhelyezkedése határozza meg. Aszerint, hogy a beépült fehérje N-terminálisa a citoszol vagy a lumen felé néz, a IVa illetve a IVb topológiai csoportba sorolják őket (5. ábra).
A IVa típusú fehérjékben az első, szignálként is működő szakasznak - a II. típusú fehérjékhez hasonlóan – az N-terminális határán lokalizálódik a pozitív töltéstöbblet. Ez determinálja a membránba illeszkedés irányát, a fehérjének a jel felbukkanása előtt szintetizálódott N-terminális vége a citoszol felé néz. Ezért aztán az első hidrofób régió a transzlokáció szempontjából is ugyanúgy, „start-transzfer” szekvenciaként viselkedik, a szintézis során növekvő peptidlánc a lumenbe nyúlik bele. A nagy alegységből felbukkanó, majd a transzlokonba jutó második hidrofób régió viszont szükségszerűen megakasztja az utána következő szakasz transzlokációját, „stop-transzferként” működik. A szintézis folytatódik, a peptidlánc immáron a citoszol felé növekszik, és ha egy újabb hidrofób régió következik, az ismét „start-transzfer” lesz, és így tovább (8. ábra).
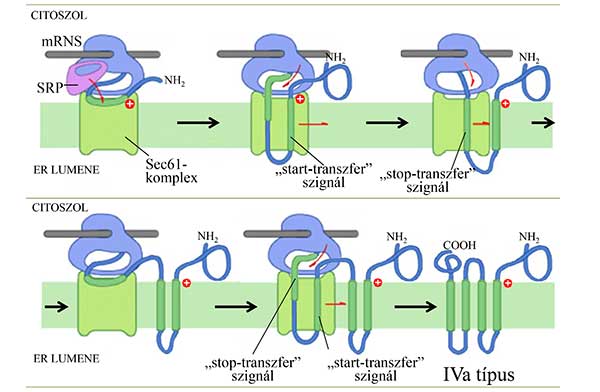
8. ábra A IVa típusú transzmembrán fehérjék szintézise és integrálódása a membránba. A legtöbb transzmembrán doménnel rendelkező fehérje orientációját meghatározza az, hogy az első szintetizálódott domén milyen helyzetben stabilizálódik a csatorna belsejében – ezt pedig az dönti el, hogy ezen szignál melyik oldalán található pozitív töltéstöbblet. Az első transzmembrán domén után felváltva, elhelyezkedésükből adódóan hol stop-transzfer, hol start-transzfer szignálként működve épülnek a membránba a soron következő hidrofób szakaszok.
IVa típusú pédául a legtöbb ioncsatorna.
A IVb csoport esetében az első hidrofób szakasz C-terminális végén csoportosul az orientációt meghatározó pozitív töltéstöbblet, ezért a rákövetkező hidrofób szakasz „start-transzfer” szekvencia, utána ismét„stop-transzfer” lesz. Innentől a membránba rendeződés a fent vázolt séma szerint történik, amíg valamennyi transzmembrán domén a helyére nem kerül. A G-fehérje-kapcsolt receptorok óriási családja ebbe a kategóriába tartozik.
Könnyen felismerhető az a törvényszerűség, hogy minden második hidrofób szekvencia ugyanúgy viselkedik, az őt megelőzővel ellentétesen helyezkedik el. Tehát az első kivételével az egymás után következő transzmembrán domének orientációját alapvetően a sorrendben elfoglalt pozíciójuk határozza meg. Ez legtöbbször valóban így is van, például ha mesterségesen eltávolítják egy fehérje egyik hidrofób szakaszát, az utána következők orientációja megfordul az eredetihez képest. Ezek a szabályok lehetővé teszik, hogy a fehérje aminosavsorrendjének ismeretében meg lehessen próbálkozni a képződő fehérje topológiájának jóslásával (9. ábra).

9. ábra Egy IVb típusú fehérje, a rodopszin hidropátiás profilja (A), és transzmembrán doménjeinek pontos elhelyezkedése a membránban (B). Az A ábrán az x tengelyen az aminosavak pozíciója, az y tengelyen az adott aminosav hidrofób (pozitív értékkel) illetve hidrofil jellege (negatív értékkel) van feltüntetve. A bekeretezett részek a szekvenciának azon, körülbelül 20 egymás utáni, többségében hidrofób aminosavból álló szakaszai, amelyek feltehetően a membránban helyezkednek el. A B ábra a rodopszin fehérjeláncának a membránba illeszkedő, illetve a citoszolba vagy az ER lumenébe nyúló aminosavjait mutatja. Az első N-terminális transzmembrán domén orientációját a citoszol felé néző pozitív töltések határozzák meg. (Figyelem, az eddigiekhez képest ezen az ábrán a citoszol van „lenn”, míg az ER lumene „felül”!)