Ahogy „A fehérjeszerkezet kialakulása az ER-ben: a dajkafehérjék szerepe” című alfejezetben olvasható, a BiP chaperon mindaddig kötődik a frissen szintetizálódott fehérjéhez, míg az megfelelő szerkezetét fel nem vette, így egyfajta ellenőrszerepet is betölt. Magasabbrendű eukariótákban két másik, a szénhidrátkötő lektinek családjába tartozó dajkafehérje viszont az oligoszacharid oldallánc állapotától függően tartja fogva a formálódó fehérjét. A kalretikulin szolubilis, míg a kalnexin membránfehérje, nevük Ca2+-függésüket jelzi. Akkor kötik a fehérjét, ha annak valamelyik cukorlánca végén a háromból egy glükóz még megmaradt (lásd 11. ábra). Az ER-glikozidázok ugyanis folyamatosan eltávolítják a terminális glükózokat, míg egy másik ER-enzim, a glikozil-transzferáz éppen ellenkező hatást fejt ki - de csak azokra az oligoszacharidokra kapcsolja rá újra a glükózt, amelyek még fel nem tekeredett fehérjéken vannak. Ily módon a nem megfelelő konformációjú fehérjék újra meg újra kikötődnek a kalnexinhez vagy a kalretikulinhoz (14. ábra) – így egyrészt nem tudnak aggregálódni, másrészt időt nyernek a további formálódáshoz, harmadrészt dajkafehérjéik kölcsönhatásaikon keresztül „odavonzzák” például a PDI-t is, ezáltal is gyorsítva a helyes térszerkezet kialakítását (lásd 12. ábra).

14. ábra Minőségellenőrzés az ER-ben. Az ER-ben lokalizálódó glikozidázok (I és II) a teljes, 14 tagú oligoszacharid-láncon a háromból csak egy terminális glükózt hagynak meg. Az ER-ben az ilyen cukorláncot felismeri és köti két chaperon, a szolubilis kalretikulin és a membránban található kalnexin (az ábrán csak ez utóbbi van feltüntetve). A glikozidáz-II az utolsó glükózt is képes levágni, ha azonban a fehérje szerkezete még nem megfelelő, egy glikozil-transzferáz újabb terminális glükózt kapcsol a cukorláncra. Ekkor újból köti a kalnexin vagy a kalretikulin, és ez mindaddig ismétlődhet, amíg a fehérje fel nem veszi végső, „érett” szerkezetét – ekkor már nem ismeri fel a glikozil-transzferáz, és kijuthat az ER-ből.
A sok segítség ellenére a fehérjék egy részének mégsem sikerül a feltekeredés. Ők pusztulásra vannak ítélve. Fontos szempont azonban, hogy - bár egyikük szerkezete sem mondható megfelelőnek - az ellenőrző rendszer meg tudja megkülönböztetni a még fiatal, „próbálkozó” fehérjéket azoktól, amelyekről már le kell mondania a sejtnek. A megoldást minden bizonnyal egy olyan, kevéssé hatékony, „lassú” mannozidáz tevékenysége biztosítja, amely leválaszt a cukorlánc egy adott pozíciójáról egy mannóz molekulát. Miután ez az enzim alacsony hatásfokkal dolgozik, a normális idő alatt összeszerelődött monomer fehérjék és komplexek nagy többsége még azelőtt távozhat az ER-ből a Golgi felé, mielőtt elveszítené ezt a mannózt cukor-oldalláncáról. Ha egy fehérje azonban túl sokat időzik az ER-ben (és ennek oka nyilván valamilyen szerkezeti hiba), akkor előbb utóbb biztosan „elkapja” a mannozidáz, és hatására egy olyan új cukorlánc-struktúra jön létre, amely jelként szolgál a degradációt lebonyolító apparátus számára.
Az ER-ben különböző mechanizmusok ellenőrzik a szolubilis illetve a membrán-kötött fehérjék állapotát, ezek közül az egyik a fentebb említett mannóz hiányának monitorozása. Korábbi elképzelésekkel szemben ma már tudott, hogy a pusztulásra ítélt fehérjék nem az ER lumenében bomlanak le, hanem a citoszolban - a folyamat neve: ER-asszociált degradáció (ERAD).
Szintézisükhöz hasonlóan a degradáció útjára is chaperonok kísérik a fehérjéket, valószínűleg egy ugyanolyan Sec61 komplexhez, amely ER-be érkezésüket biztosította. Diszulfid-kötéseik felbomlanak, cukor-oldalláncaikat elvesztik, és a Sec61 komplex és más, a csatornához asszociálódott fehérjék segítségével a citoszoba kerülnek (retro-transzlokáció).
A citoszol felőli oldalon kifejezetten az ERAD-ra „szakosodott”, az ER membránjához lokalizált ubikvitin-konjugáló és ubikvitin-ligáz enzimek fogadják az átjutott fehérjéket, és a rájuk került poliubikvitin jel hatására végezetül a proteaszóma lebontja őket. A mechanizmus lépései még pontosan nem ismertek, de a folyamatot biztosító energiaforrással kapcsolatban azt feltételezik, hogy a transzlokon citoszol felőli oldalán várakozó, a poliubikvitin-jelet felismerő ATP-ázok „húzzák ki” a fehérjéket az ER lumenéből és továbbítják őket a proteaszómához (15. ábra).
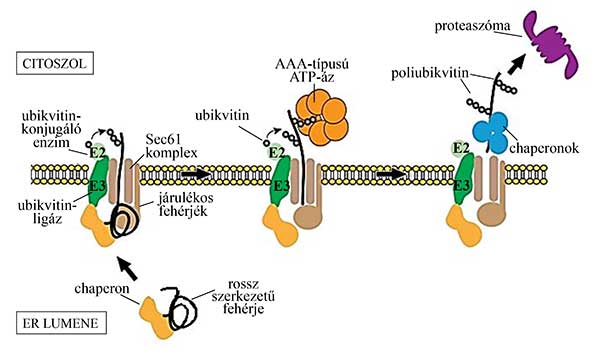
15. ábra Az ER-hez kapcsolódó fehérjebontás (ERAD) lépései. A javíthatatlanul torz szerkezetű fehérjéket az őket fogva tartó chaperonok a Sec61-transzlokon, ubikvitin-konjugáló enzim, ubikvitin-ligáz, valamint más járulékos fehérjék alkotta komplexhez szállítják. A hibás fehérje citoszolba jutását ATP-áz biztosítja, az ubikvitin-konjugáló enzim és az ubikvitin-ligáz poliubikvitin oldalláncokkal látja el, és citoszolikus chaperonok a proteaszómához továbbítják, ahol aminosavjaira bomlik.
Ha valamilyen stressz – tipikusan hőstressz - éri a sejtet, az hatással van a fehérjék szintézisére és szerkezetének alakulására. A sejt és az egész szervezet számára létfontosságú, hogy ilyen helyzetekben gyorsan és megfelelően reagáljon. Az alapvető folyamatok biztosításának érdekében a hibás szerkezetű fehérjék abnormális felhalmozódása azonnal vészjelként szolgál. Transzkripciós szintű változásokat indukál mind a citoplazmában (hősokk-válasz), mind az endoplazmatikus retikulumban (UPR, unfolded protein response, azaz „szerkezet nélküli” protein-válasz). Ehelyütt csak az ER-ben játszódó folyamatokra térünk ki.
Az UPR nem véletlenül tartozik szervesen az ER-hez rendelt tevékenységek körébe. Ha valami zavar lép fel a szekréciós fehérjék szerkezetének kialakulása közben (akár egy mutáció következtében), az ER nem engedi tovább a hibás terméket, az felhalmozódhat, „eltömítheti” az ER-t - ami végül a sejt pusztulásához vezethet. Az UPR több úton próbál megoldást találni: ER-dajkafehérjék szintézisének serkentésével, a végérvényesen hibás formák degradációjának elősegítésével, illetve a transzláció általános gátlásával. Ha már nem menthető a helyzet, az UPR apoptózist indukál.
Stresszmentes helyzetben az ER egy membránreceptorának (PERK: protein kinase RNA-like endoplasmic reticulum kinase) lumen felőli részéhez kötődik a nem túlságosan „elfoglalt” BiP chaperonok egy része, és akadályozza dimerizációját. Amint az összes BiP-nek munkába kell állnia, mert lekötik őket a hibás konformációjú fehérjerészletek, a PERK oligomerizálódik, foszforilálódik, és így aktiválódik. Citoszolikus része foszforiláció által közvetlenül gátolja a transzlációhoz szükséges eIF2 iniciációs faktort. Ennek az a következménye, hogy általában lecsökken a transzláció szintje (így kevesebb fehérje érkezik az ER-be is), és ennek hatására a sejtciklus is megáll a G1 fázisban (16. ábra).
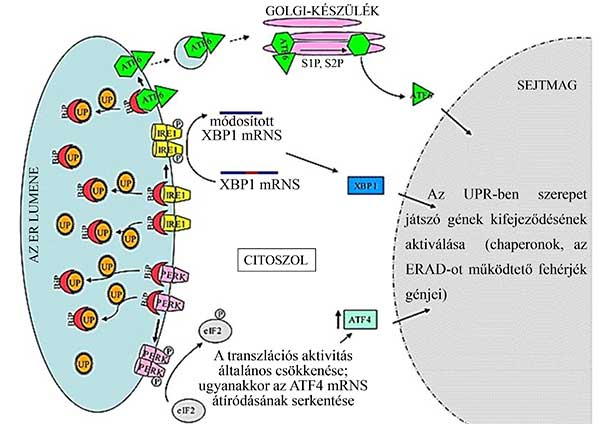
16. ábra Az ER-stressz kezelésében szerepet játszó legfontosabb folyamatok. Mindhárom mechanizmus esetében a hibás szerkezetű fehérjék (UP: unfolded protein) megnövekedett szintje a BiP chaperonokat „leköti”, elvonja őket a membránba ágyazódó ATF6 fehérjétől illetve az IRE1 és PERK receptoroktól. - Ennek hatására a PERK receptorok dimerizálódnak és aktiválódnak, kináz-aktivitásuk révén foszforilálják az eIF2 transzlációs iniciációs faktort. A transzláció mértéke általában lecsökken, de egy specifikus transzkripciós faktor (ATF4) szintézise fokozódik. Az ATF4 az ER-stressz kivédését elősegítő fehérjék expresszióját serkenti. - Hasonló módon aktiválódik az Ire1 receptor, amelynek különleges hatása van: képes egy intront kivágni az XBP1 fehérjét kódoló mRNS-ből, ennek hatására aktív XBP1 transzkripciós faktor szintetizálódik a citoszolban, amely a sejtmagban szintén az ER-stressz ellen ható géntermékek kifejeződését indukálja. - Az ATF6 membránfehérje a BiP chaperonoktól megszabadulva képes lesz vezikuláris transzporttal a Golgi-készülék területére jutni, ahol az S1P és S2P proteázok levágják citoszolikus doménjét, amely transzkripciós faktorként ismét csak az ER-stressz ellen hat.
Az UPR transzkripciós szinten is hat. De vajon hogyan tud az ER vészjeleket küldeni a sejtmagba? Maga a fentebb említett PERK is részt vesz ebben: miközben a transzláció általában gátlódik, egy transzkripciós faktor (ATF4, activating transcription factor 4) mRNS-ének átíródása megnő. Az ATF4 pedig serkenti az UPR-ben szerepet játszó fehérjék génjeinek átíródását.
A transzkripciós szintű válasz kiváltásának érdekes módja az élesztőkben felfedezett, azóta emlősökben is azonosított Ire1 (inositol requiring kinase 1) receptoron keresztül történik. Az Ire1 az ER membránjában lokalizálódó transzmembrán fehérje, stresszmentes állapotban a PERK-hez hasonlóan monomer, a BiP chaperonok kötődése miatt. Stressz hatására az Ire1 is dimerizálódik és autofoszforiláció révén aktiválódik. Citoszol felőli egyik doménje képes egy specifikus mRNS-t intronkivágás által úgy módosítani, hogy ennek hatására a citoszolban lévő riboszómákon aktív transzkripciós faktor képződik róla, amely ER-stressz-géneket aktivál a sejtmagban (16. ábra).
Egy másik útvonal egy olyan transzkripciós faktoron (ATF6: activating transcription factor 6) keresztül lép működésbe, amely szintézise során az ER membránjába integrálódik, és ott is marad, mert a szabad BiP chaperonok (a PERK és Ire1 receptorokhoz hasonlóan) kötődnek hozzá, és az ER-ben tartják. Ezért normális körülmények között nem képes a sejtmagba transzlokálódni. Stressz hatására a BiP-eket „elszólítja a kötelesség”, az ATF6 a szekréciós utat követve a Golgi készülék membránjába kerül. Ott Golgi-specifikus membrán-proteázokkal találkozik, lehasad egy citoszolikus darabja, amely leucin-cipzár típusú DNS-kötő doménjével ismét csak az UPR-ben szerepet játszó géneket képes aktiválni (16. ábra).
Az eredetileg az ER és a sejt túlélésének védelmében aktiválódott, UPR-t serkentő receptorok hosszútávú aktiváltsága végül pro-apoptotikus gének serkentéséhez vezet, és az egész sejt apoptózis által bekövetkező pusztulását katalizálja.