Rögtön a lefűződés tárgyalása kapcsán előkerül az a kérdés, hogy hogyan alakulhat ki egy új membrán-identitás. Hiszen ennek során a donor membrán – bármi is legyen az – egy kis területe másképp kezd el viselkedni, új sorsot kezd követni, nyilvánvalóan valaminek meg kell változnia az eredeti összetételhez képest.
Ennek látványos, fénymikroszkópban is jól látható eleme a membrán citoszolikus oldalán kezdődő burokképződés (3. ábra),
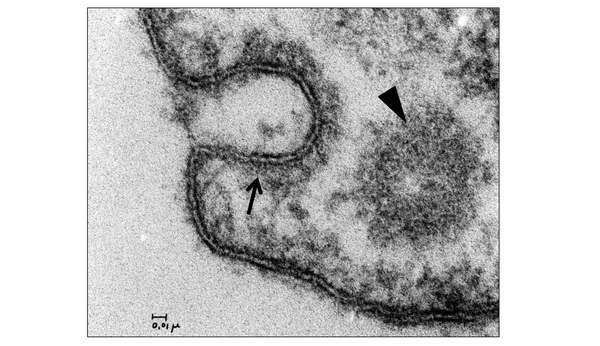
3. ábra. Klatrin-burkos vezikula elektronmikroszkópos képe lefűződés közben (→), és lefűződés után (tangenciális metszetben, ► )
amelyben speciális, a membrán görbülését elősegítő burokfehérjék vesznek részt. Ezek különböznek az eltérő irányokba közlekedő vezikulákon: COPII típusú burok (COP: coat protein) alakul ki az ER-től a Golgi-készülék felé irányuló anterográd (előre haladó) transzportban, COPI típusú a Golgi-készülék felől az ER felé és a Golgi-készülék egyes ciszternáiból visszafelé haladó, úgynevezett retrográd transzport során, és klatrin veszi körbe a többi irányban haladó vezikulák többségét (4. ábra).
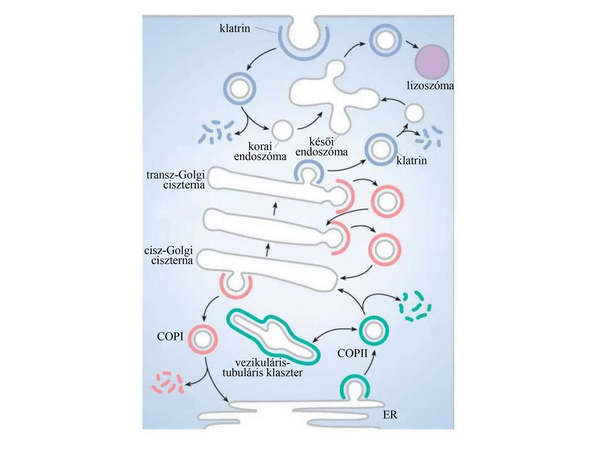
4. ábra. A három legismertebb burokfehérje (COPI, COPII és klatrin) részvételével zajló transzportfolyamatok
Több mint tíz éve fedezték fel az úgynevezett retromer komplexet, amely az endoszómáktól a transz-Golgi hálózat felé közlekedő vezikulák felszínén található. Ezekről később esik részletesebben szó. Ugyanis a lefűződést kiváltó folyamat a burok kialakulásánál korábban kezdődik, és a főszerepet GTP-kötő, úgynevezett kis G-fehérjék játsszák benne.
A kis G-fehérjék GTP-áz aktivitással rendelkező, a sejt számos életfolyamatában központi szerepet játszó, kapcsolóként működő molekulák. Aktivitásuk a GTP jelenlétéhez kötött, amelynek GDP-vé hidrolízisét GAP-ok (GTP-ase activating protein), a GDP GTP-vé cserélését a GEF-ek (guanine exchange factor) serkentik. Ily módon a GAP-ok a kis G-fehérjék aktivitásának kikapcsolásában, a GEF-ek pedig bekapcsolásában vesznek részt (lásd még: 7. fejezet, 6. ábra). A COPII-burok kialakulásában a Sar1, a COPI- és a klatrin-burok kialakulásában pedig az ARF (ADP rybosilation factor) nevű kis G-fehérje játszik szerepet. 30 különböző ARF-ot azosítottak eddig emlősökben.
A vezikulaképződés kezdetén a donormembrán egy kis területén aktiválódnak a megfelelő Sar1-GEF illetve ARF-GEF-ek, melyek integráns membránfehérjék. Aktiválódásukhoz valószínűleg a kompartmentből elszállítandó „cargo” molekulák – jelenléte és receptorhoz kötődése vezet, amely változást idéz elő a receptor szerkezetében és hozzájárul a GEF-ekkel történő interakcióhoz. Az aktív GEF odavonzza a GDP-kötött, inaktív formájában szolubilis kis G-fehérjét, és elősegíti a GDP-GTP cserét. Ennek hatására a G-fehérje konformáció-változáson esik át, felszínére kerül hidrofób N-terminálisa (az ARF esetében egy mirisztoil-csoport is), ezáltal a membrán citoszolikus felszínére horgonyzódik (5. ábra).
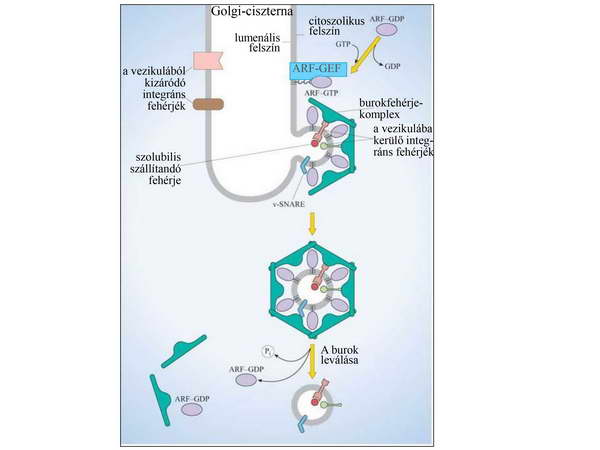
5. ábra. Kis G-fehérjék szerepe a burok képződésében és leválásában. Az ábrán a COPI-es burok kialakulásában szerepet játszó ARF (ADP rybosilation factor) és GEF-je (guanine exchage factor) szerepel. A v-SNARE a célmembránnal történő fúzióban szerepet játszó fehérje.
A donormembránba lokalizálódott aktív kis G-fehérje kezdi aztán kölcsönhatásai révén maga köré gyűjteni mindazokat a fehérjéket, amelyek 1) szükségesek a membrán görbítéséhez, 2) további szolubilis és membránfehérje „cargo”-t kötnek meg, és 3) hozzájárulnak a vezikula identitásához, azzal, hogy meghatározzák a leendő célállomást is. Ezek közé tartoznak a már említett burokfehérjék, amelyek a membrán formálása mellett egyes esetekben cargo-receptorok kötésével a szállított molekulák szelektálásában is részt vesznek; maguk a cargo-receptorok és adapterfehérjék is (5. ábra). A fogadó kompartment membránjával történő fúzióhoz nélkülözhetetlen az úgynevezett SNARE (SNAP receptor – a SNAP-okról később lesz szó) fehérjecsalád, közülük a v-SNARE-k a vezikulák, a t-SNARE-k a cél- (target) membrán felszínén vannak, szerepüket részletesebben később tárgyaljuk. Ugyanígy, már ekkor beépülnek egy másik kis GTP-áz alcsalád, a Rab-ok GEF-jei, szintén a fúzió bemutatása során lesz róluk szó.
A burokfehérjék szerkezeti egysége monomerekből felépülő komplex. A COPI hét különböző monomerből szerelődik össze, a COPII-t kétféle heterodimer képezi, a klatrinburok pedig három „könnyű” és három „nehéz” klatrinfehérjéből összeálló, különleges háromágú, úgynevezett triskelion alegységből épül fel. A klatrinburok esetében egy adapterekből kialakuló belső gömbhéj is kialakul (6. ábra).
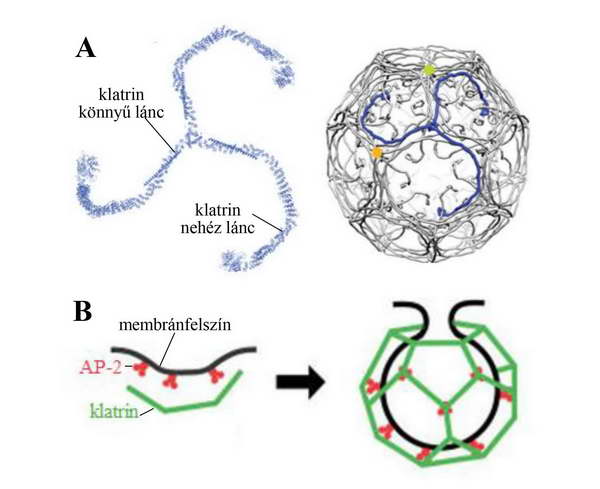
6. ábra. A: A klatrin triszkelion szerkezete és az összeszerelődött klatrinburok. B: A membrán görbítését a klatrin adapterekkel együtt végzi, az ábrán az AP2 (adapter protein 2) komplex látható.
Ezek a burkok alapegységeik szabályos összeilleszkedésével egységes kosárszerű képet mutatnak. A retromer komplex, amely a Golgi felé irányuló retrográd transzportban az endoszómák felszínén öt alegységből áll össze, ezzel szemben kevésbé szabályos, tubuláris szerkezetű lefűződéseket tesz lehetővé. Abban is különbözik a régebb óta ismert burokfehérjéktől, hogy már eleve enyhén hajlított membránon tud kialakulni (7. ábra).

7. ábra. A retromer komplex elsősorban tubuláris szerkezetű membránfelszínen jön létre. Az ábrán egy ilyen endoszóma-cső keresztmetszete látható, amelyet körbefog az öttagú komplex: a teljes retromert a membrán felszínére toborozó SNX-BAR dimer és a szállítmány (cargo) kötéséért felelős Vps35/Vps29/Vps26 trimer. A retromer csak foszfatidil-inozitol 3-foszfát (PI(3)P)-tartalmú membránon (így elsősorban endoszómán) szerelődik össze.
A burokfehérjék membránhoz vonzásában nemcsak a kis G-fehérjék, hanem lipidkomponensek is szerepet játszanak. A membránban található foszfatidil-inozitolra kerülő foszfátcsoportok különböző kombinációi az endomembrán rendszer más-más tagján jönnek létre, így a fehérje-összetevők mellett lipidek is részt vesznek a membránok identitásának kialakításában (8. ábra).
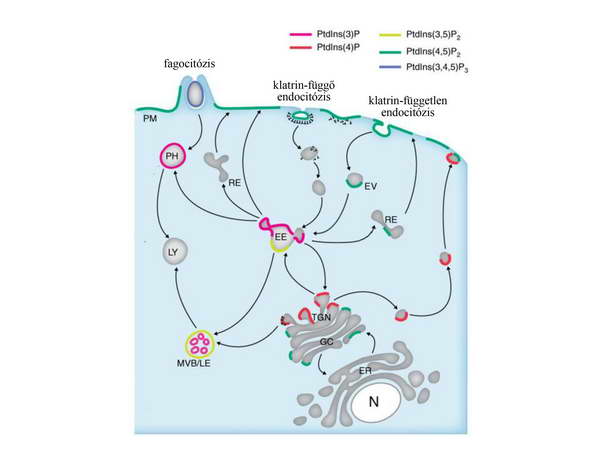
8. ábra. A különböző foszfatidil-inozitol-foszfátok eloszlása az endomembrán rendszer tagjainak felszínén. N: sejtmag (nucleus); ER: endoplazmatikus retikulum; GC: Golgi-ciszternák; TGN: transz-Golgi hálózat; EV: endocitotikus vezikula; EE: korai (early) endoszóma; RE: reciklizáló endoszóma; MVB: multivezikuláris test (body); LE: késői (late) endoszóma; LY. lizoszóma; PH. fagoszóma. A jelen fejezetben nem tárgyalt kompartmentekről a szekréciós utat illetve az endocitózist bemutató fejezetekben lehet tájékozódni.
Például a plazmamembrán jellegzetes alkotója a foszfatidil-inozitol 4,5 bifoszfát (PI(4,5)P2), amelynek jelenléte szükséges a klatrinburok belső rétegét alkotó adapterfehérjék kötődéséhez, így az endocitózis első lépéseihez.
A membránhoz kötődött burokfehérjék újabb burok-komponensekkel lépnek interakcióba, egyfajta polimerizáció következik be. Ahogyan számuk növekszik a donormembrán egy területén, szerkezetükből adódóan fokozzák a membrán görbülését, végül kialakul a buroktípusra jellemző méretű hólyagocska.
A vezikula leválását egy dinamin nevű motorfehérje teszi lehetővé. Spirálszerűen körbeveszi a nyakrégiót, GTP-hidrolízis hatására megnyúlik, elszakítva a nyakat a donormembrántól. Először a legintenzívebben kutatott klatrin-burkos vezikulák lefűződésével kapcsolatban azonosították, ma már úgy gondolják, hogy a dinamin vagy dinamin-szerű fehérjék minden vezikula leválásánál jelen vannak (9. ábra).
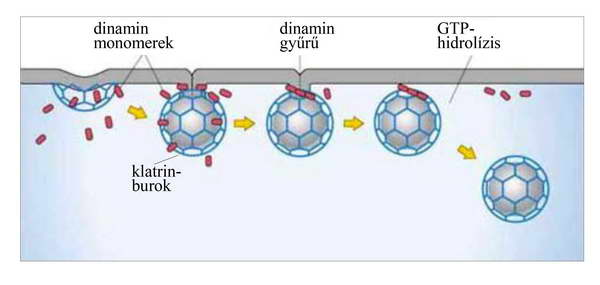
9 . ábra. A dinamin szerepe a vezikula leválásában. A dinamin-monomerek spirális formában oligomerizálódnak a formálódó vezikula „nyaka” körül. GTP-hidrolízis hatására konformációt váltanak, összehúzzák a nyakat és kiváltják a rendkívül közel kerülő lipidrétegek fúzióját. A GTP-hidrolízis után nem sokkal elhagyják a membránt.