A TGN-ben zajló osztályozás legkorábban megismert eleme a lizoszómába kerülő, ott működő szolubilis és membránfehérjék szelektív kiválogatása volt. Ehhez a ritka lizoszomális betegségek tanulmányozása vezetett. Ezek a genetikai rendellenességek azzal járnak, hogy valamilyen – vagy súlyos esetben mindegyik - bontóenzim hiányzik „munkahelyéről”, a lizoszómából, ezért a sejtek nem képesek megemészteni az oda bejutott anyagokat. Néhány esetben az enzimek ugyan rendben szintetizálódtak és kotranszlációs transzlokációval bejutottak az ER-be, de megfelelő jel hiányában a TGN-ből kikerülve konstitutív szekrécióval kiürültek a sejtből. Genetikai és biokémiai módszerekkel sikerült azonosítani az ilyen páciensekből mutáció következtében hiányzó fehérjéket, és így fény derült azokra a folyamatokra, amelyek a bontóenzimek lizoszómába vezető útját biztosítják.
A lizoszómában működő bontóenzimek valamennyien szolubilis savas hidrolázok, amelyek csak a lizoszómában uralkodó igen alacsony, 4-4,5-ös pH-n működőképesek, mert odavezető útjuk során inaktív proenzim formában vannak. Csak a lizoszóma erősen savas, a többi sejtalkotótól elzárt közegében következik be az aktiválódást biztosító specifikus proteolízisük (a proteolízis jelentőségét a szekréciós út kapcsán már említettük).
A lizoszóma-specifikus membránfehérjék közé tartoznak – többek között - a különféle transzporterek, amelyek az elbontott makromolekulák építőköveit juttatják vissza újrahasznosítás céljából a citoszolba, illetve a lizoszóma részvételével zajló sokféle vezikuláris transzportot biztosító, a dokkoláshoz, fúzióhoz és a lefűződéshez szükséges komponensek. Ezek általában erősen glikoziláltak, ami védelmet biztosít a lizoszóma membránjának a savas hidrolázok emésztésével szemben.
A szolubilis lizoszomális fehérjék (más, aminosav-szekvencián alapuló válogatási jellel szemben) valamennyien N-glikozidos cukor-oldalláncukon módosulnak, egy mannóz-6-foszfát (M6P) jelet kapnak még a CGN területén. Ez azt jelenti, hogy az ER minőség-ellenőrzésén átjutó, még egységesen két N-acetil-glükózaminból és nyolc mannózból (lásd 8. ábra) álló cukorfácska valamely, akár több mannózának 6. szénatomjára foszfátcsoport kerül.
De ha valamennyi, ER-ből kijutó fehérje ugyanazt a cukorláncot viseli, hogyan kaphatnak csak a lizoszomális enzimek M6P jelet? A specificitást egy N-acetil-glükózamin-foszfotranszferáz enzim biztosítja, amely felismer egy, csak a savas hidrolázokon megtalálható, több felszíni fehérjerészletből összeálló folt-jelet. A kötődés után az enzim (nevéhez méltóan) foszforilált N-acetil-glükózamint kapcsol - akár több cukorláncon is - egy mannóz 6. szénatomjára (15. ábra).
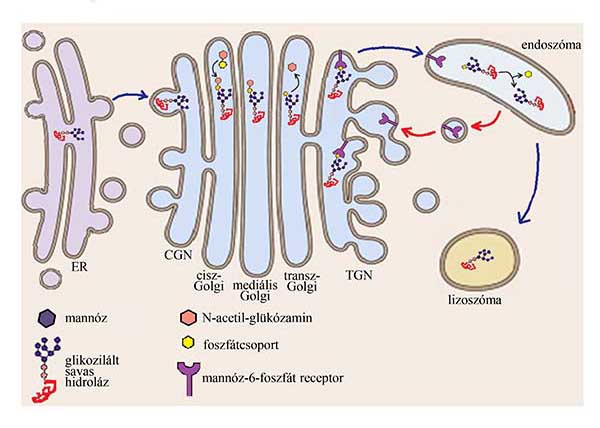
15. ábra A lizoszomális enzimek transzportja. A cisz-Golgi ciszterna területén az N-acetil-glükózamin-foszfotranszferáz N-acetil-glükózamin-foszfáttal jelöli meg egyes mannózain a térszerkezete alapján felismert savas hidrolázokat. Ezek után a cukoroldallánc már csak a transz-Golgi ciszternában módosul, ahol levágódik róla az N-acetil-glükózamin. A transz-Golgi hálózat területén a maradék foszfátcsoportot 6. szénatomján tartalmazó mannózokat megköti a mannóz-6-foszfát receptor, és a késői endoszómába (speciális esetekben közvetlenül a lizoszómába) irányuló vezikulákba csoportosul (az ábrán a burokfehérjék nincsenek jelölve). Az endoszóma savasabb közegében a receptor elengedi a szállított fehérjét, amelyről a foszfátcsoport is nyomban levágódik. A receptor reciklizálódik a Golgi-készülék területére, a savas hidroláz pedig végül a lizoszómába jut.
A lizoszomális betegségek egy különösen súlyos fajtájában, az úgynevezett I-sejtes betegségben (I, mint inclusion, azaz zárvány) az összes lizoszomális enzim hiányzik. Ezt okozhatja az, hogy éppen az N-acetil-glükózamin-foszfotranszferáz szintézise gátlódik mutáció következtében (más esetekben az M6P-receptor hiányzik, lásd alább).
A módosítás megakadályozza a Golgi-készülék ciszternáiban működő glikozidázok további bontó tevékenységét, így változatlan cukorlánccal rendelkezik az egy vagy több M6P jelet hordozó lizoszomális fehérje a transz-Golgi ciszternában is. Ott az N-acetil-glükózamint a foszfátcsoport mentén aztán leválasztja egy foszfodiészteráz, és marad a foszfáttal kötött 6. szénatom (15. ábra), amelyet a TGN membránjában lokalizált M6P-receptor köt meg.
Míg az M6P-receptor lumen felőli szakaszán a módosult mannózzal lép kölcsönhatásba, addig citoszol felé néző része adapterfehérjékhez kötődik, és elkezdődik a burokfehérjék toborzása is. A TGN-ről lefűződő vezikulák közül a lizoszóma felé indulók szerkezete a legismertebb. Hat monomerből (három könnyű és három nehézláncból) álló, „háromlábú” klatrin triskelionok alkotják a külső héjat, polimerizációjuk a burok belső héját alkotó AP1-es (adapter protein 1), vagy a rokon GGA (Golgi-localized, gamma adaptin ear-containing, ARF-binding) fehérjékből álló komplexek összeszerelődésével párhuzamosan, velük kölcsönhatásban zajlik (lásd 8. fejezet, 6. ábra). Többféle AP-komplex létezik, ezek más-más funkciójú transzport-vezikulák klatrinburkának alkotásában, ezáltal más fehérjék szállításában vesznek részt (lásd később, illetve az endocitózisról szóló fejezetben). A burok összeszerelődésében itt is ARF GTP-ázok játszanak szerepet, csakúgy, mint a COPI-es burok esetében (újabban kimutatták a COPI-et alkotó héttagú fehérjekomplex és a klatrin/AP-komplex együttese közötti szerkezeti rokonságot is).
Egyetlen AP komplex maga is négy alegységből áll, amelyek az AP1 esetében nemcsak az M6P-receptorokat, hanem a membránba integrálódott lizoszomális fehérjéket is szelektíven kötik. Nemrég azonosították az egyik válogatási jelet, amely alapján ez a kölcsönhatás létrejöhet: ez egy négy aminosavból álló YXXФ szekvencia (Y: tirozin, X: bármilyen aminosav, Ф: hidrofób aminosav). A szintén lizoszomális fehérjéket kötő GGA adapterfehérjék ettől eltérő, aszparagin-tartalmú jelet ismernek fel. Ily módon a TGN membránjában speciális összetételű folt jön létre, benne a lizoszómára jellemző membránfehérjékkel és az M6P-receptorokkal. A folt lumen felőli oldalán az M6P-receptorhoz kötött savas hidrolázok csatlakoznak, a citoszol felől pedig közvetlenül az AP1-es vagy GGA adapterből álló réteg, azon pedig a polimerizálódott klatrinból álló burok rögzül.
A megfelelő görbületet elért vezikula dinamin segítségével lefűződik, (8. fejezet 9. ábra), majd a burok leválása után egy (korai vagy késői) endoszómával fúzionál. Az endoszómákról részletesebben a 18. fejezetben esik szó. Itt csak annyit említünk meg, hogy a lizoszómába vezető lebontó útvonalak egy köztes állomását képező sejtalkotók, emésztendő anyagokat is tartalmazó, a koraitól a késői endoszóma felé haladva savasodó beltartalommal. A pH 6-nál savasabb, a késői endoszómákra jellemző könyezetben az M6P-receptor elengedi a szállított savas hidrolázt, ráadásul a késői endoszómában működő foszfatázok a foszfátcsoportot is leválasztják a mannózról. Az M6P-receptor, együtt más, TGN-specifikus membránfehérjével (például ARF-GEF, v-SNARE) szelektíven reciklizálódik: egy nemrégiben felfedezett burokalkotó, a retromer komplex (lásd 8. fejezet 7. ábra) segítségével lefűződő vezikula visszaszállítja őket a Golgi-készülék transz oldalához (15. ábra).
A késői endoszóma membránja és lumene tehát már tartalmazza a lizoszómára jellemző fehérjekészletet. Beltartalmának savassága még nem éri el a lizoszómáét, de a membránba került protonpumpák működésével pH-ja egyre csökken, majd egy meglévő lizoszómával fúzionálva maga is részévé válik. A késői endoszómát (főleg állati sejtekben) sokan tekintik a lizoszóma egy érési stádiumának.
A lizoszómába azonban közvetlenül is vezethet út a TGN felől. Az ide tartó vezikula burkában AP3 típusú komplexek sokasága alkotja a belső héjat, míg kívülről valószínűleg ugyanúgy klatrin borítja. Ez az útvonal azonban főleg speciális sejttípusokra, például a melanocitákra jellemző, ahol a lizoszóma-eredetű melanoszómába szállítódnak így a fehérjék.
A savas hidrolázok, ha kis mennyiségben is, de belekerülhetnek a TGN-ből lefűződő konstitutív szekréciós vezikulákba is, és az extracelluláris térbe juthatnak. Ott ugyan nem aktívak, de a sejt gondoskodik visszavételükről: néhány M6P-receptor ugyanígy kikerül a plazmamembránba, majd megkötve a „megszökött” lizoszomális enzimet, receptor-mediált endocitózissal (lásd 18. fejezet) visszaszállítja a késői endoszómába.