A PTM (acetiláció, metiláció, foszforiláció, ubikvitiniláció és szumoiláció) jelenségét eredetileg hisztonokkal kapcsolatban írták le. A hisztonok az eukarióta DNS állomány kompakt összecsomagolását biztosító nukleoszómák alkotói, amelyek a DNS-szálon mint gyöngyszemek helyezkednek el. Alapvetően meghatározzák a kromatin állomány eukromatikus és a heterokromatikus állapotát, s a kettő közötti átmenet lehetőségét.
A nukleoszóma H2A, H2B, H3 és H4 hisztonokból szerveződő fehérje komplexum, amelyet a felsorolt hisztonok két-két példánya alkot. A H1 hiszton a DNS internukeoszómális szakaszán kötődik a DNS-hez, s a nukleoszómára felfutó, valamint az annak felszínét elhagyó DNS szálat „fogja”, ezzel stabilizálja az internukleoszómális és egyben a hisztonra felfutó szakasz szerkezetét is (10.A ábra).
A hisztonokat érintő kovalens módosítások a következők: szerin vagy treonin oldalláncon történő foszforiláció (kinázok, foszfatázok végzik), lizinen keresztüli acetiláció (acetiláz és deacetiláz enzim végzi, l. 10.B–D ábra), lizinen és metionin oldalláncon történő metiláció (hiszton metiltranszferázok és demetilázok végzik) lehet. A hisztonokon kialakuló PTM mintázat az úgynevezett hiszton-kód. Nyilvánvaló feltételezés, hogy a hisztonok, így a nukleoszóma szerkezetét érintő bármely változás, azaz maga a hiszton-kód befolyásolja a kromatin állomány működését, meghatározza a génműködést, a génexpresszió intenzitását, a hisztonok pozícóját, valamint hatással van a sejtosztódásra is.
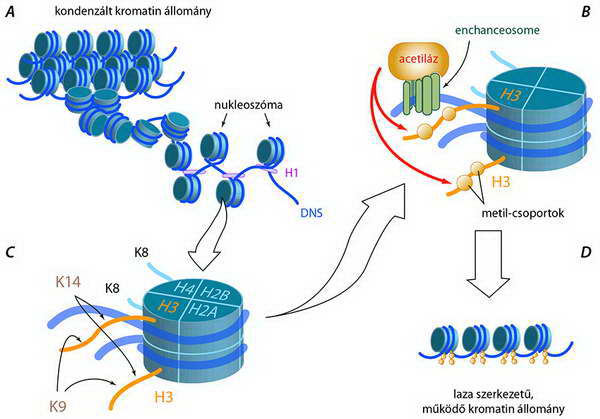
10. ábra. A kromatin állomány nukleoszómás szerkezete és a hiszton-metiláció: az ábra a H3 hiszton N-terminálisát érintő metilációs lehetőségeket mutatja. Az enchansosome egy olyan komplex, amely egy gén szabályozó régiójához kapcsolódva a gén átírásának intenzitását képes növelni, mint látjuk, a H3 hiszton metilációján keresztül, hiszen hozzá kapcsolódik a acetilációt végző acetiláz enzim
A hisztonokon megjelenő egyedi kovalens módosítások kombinálódnak, erősíthetik és gyengíthetik egymást, ami azt jelenti, hogy hatásukat egy komplex környezetben lehet csak értelmezni. Régebben úgy gondolták, hogy az acetiláció génexpresszió fokozódást, a metiláció annak csökkenését eredményezi. Újabb adatok szerint a helyzet bonyolultabb, hiszen például a H3 hiszton Lys9 metilációja repressziót, míg Lys4 oldalláncának metilációja aktivációt eredményez. A lehetséges mintázatok számát tovább növeli az, hogy egy oldallánc nem csak egy, hanem két vagy három metil-csoportot is kaphat (mono-, di- és tri-metiláció), s ezen jelölések – a kromatin állomány működése szempontjából – akár teljesen eltérő eredményre is vezethetnek.
Az is bebizonyosodott, hogy a hisztonok szerkezetét érintő, akár különböző típusú módosításokat nem lehet különálló, egymástól független folyamatokként tekinteni: az egyik oldalláncra felkerülő PTM ugyanis befolyásolja más modifikációs helyek sorsát is („crosstalk”). A hiszton-kód tehát egy nagyon komplex, térben és időben dinamikusan változó mintázat.
Összefoglalóan, egy hasonlattal élve, a nukleoszómákat érintő egyedi módosítások hatása olyan módon vesz részt a kromatin állomány működését meghatározó végeredmény kialakításában, mint egy-egy művész hangszeres játéka egy szimfónikus zenekar produkciójában.