A mikrotubulusok a sejtek citoplazmájában elhelyezkedő kb 24-25 nm átmérőjű,áltakozó számú és hosszúságú csövek (1.ábra), melyek αβ tubulin heterodimerek polimerizációjával jönnek létre.

1. ábra Mikrotubulus-hálózat (zöld) kimutatása a sejtekben immunfestéssel, a sejtmagok kék színűek.
Az α illetve β tubulin két egyenként kb. 450 aminosavból álló, egymáshoz szerkezetében és molekula tömegében hasonló globuláris, kb 4nm átmérőjű fehérje, szintézisüket követően állnak össze 8nm hosszúságú heterodimerré (2. ábra).
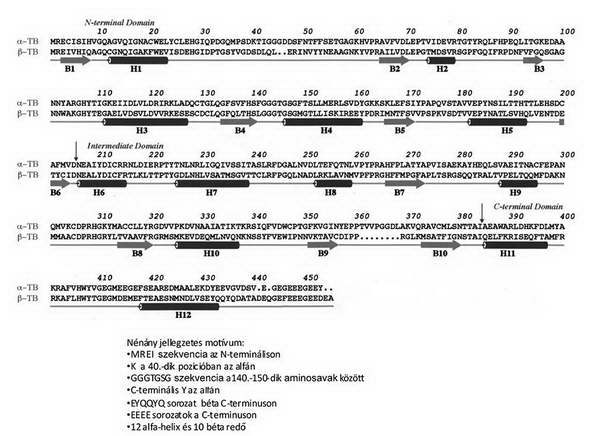
2. ábra Szarvasmarha tubulin szekvenciák
A mikrotubulusok “minusz“ végéhez a tubulin fehérje család egy harmadik tagja a tubulin is kapcsolódhat. A tubulin a mikrotubulusok nukleációjában játszik szerepet (l. alább). A heterodimer mindkét tagja képes egy-egy GTP molekulát megkötni. A polimerizáció során, mely a heterodimereknek a cső végeire történő asszociációjával valósul meg, a tubulinhoz kötött GTP elhidrolizál, míg az β tubulinhoz kötött GTP változatlan marad. Ezért a cső belsejében a heterodimerek β alegységei GDP tartalmúak, míg a csövégeken a β alegységek lehetnek GTP, vagy GDP-töltött formában (l. alább). A GTP hidrolízisnek fontos szerepe van a mikrotubulusok dinamikájának szabályozásban.
A polimerizáció során, mely kémcsőben is jól tanulmányozható, a tubulin-heterodimerek „fej-farok” orientációban (az egyik dimer α-alegysége a következő dimer β-alegységéhez kötődve: αβ,αβ,αβ…sorozatban) összekapcsolódnak és fonalszerű struktúrákba, protofilamentumokba szerveződnek. Tipikusan 13 ilyen protofilamentum laterálisan egymáshoz illeszkedve és egymáshoz képest kissé elcsúszva alakítja ki a mikrotubulus jellegzetes hengeres formáját(3.ábra).

3. ábra A mikrotubulus szerkezete. A tipikus MT 13 protofilamentumból áll össze. A protofilamentumot alfa-béta heterodimerek sorozata alkotja. Az egyes protofilamentumok egymáshoz képest kb. 0,9 nm-es elcsúszással kapcsolódnak laterálisan egymáshoz. A protofilamentumokban laterálisan béta-béta, ill. alfa-alfa kapcsolat van (ez a B-mintázat), de az elcsúszás miatt az 1.-13.-ik profilmentum között alfa-béta laterális kapcsolat van. Ez a „varrat”. Az MT két vége különbözik: a „ +” végen a béta (piros), a „–” végen az alfa (fehér) alegységek lógnak ki.Elektronmikroszkópos felvételen a protofilamentumok és bennük a heterodimerek gyöngysor szerű szálakként tűnnek fel.
A hengert a heterodimérek közötti hosszanti és oldalirányú kapcsolatok stabilizálják. Mivel a protofilamentum két vége nem egyforma (az egyiken a legszélső dimér β tagja, a másikon az α lóg ki), a belőlük szerveződő mikrotubulus is polarizált szerkezetű: egyik, úgynevezett “gyors”, vagy “+”(plusz) végén szabad β, míg másikon ( “lassú”, vagy ”-“ azaz minusz vég) szabad α alegységeket hordoz.
A mikrotubulus növekedése vagy rövidülése újabb és újabb heterodiméreknek a mikrotubulus végeire történő ráépülésével, ill. disszociációjával valósul meg. A polimerizáció elsősorban az oldat szabad heterodimer koncentrációjától függ: ha ez magas, az asszociáció kerül túlsúlyra és a mikrotubulus növekedni fog, alacsony értéknél viszont a tubulin alegységek leválnak és a cső kezd rövidülni. Azt a szabad dimerkoncentrációt, melynél az időegység alatt történő ráépülés és leválás éppen kiegyenlíti egymást, kritikus koncentrációnak nevezik. A kritikus koncentráció a cső két végére nézve nem egyenlő: a “gyors” végen alacsonyabb, mint a “lassú” végen. Ezért létezik olyan dimerkoncentráció-tartomány, ahol a mikrotubulus gyors vége még növekszik, miközben a lassú vége már rövidül: a mikrotubulus folyamatosan átépül, miközben hossza lényegesen nem változik. Ez a “mókuskerék” állapot (taposómalom, mozgólépcsőzés): a mikrotubulusok dinamikus viselkedésének egyik megnyilvánulása.
A dinamikus viselkedés mikrotubulusokra legjellemzőbb másik formája a dinamikus instabilitás. Ez abban nyilvánul meg, hogy a sejtben az egyedi mikrotubulusok gyors növekedési fázisból hirtelen depolimerizációba váltanak (“katasztrófa”), majd újra növedni kezdenek (“menekülés”), miközben a szabad dimer koncentráció lényegesen nem változik (4.ábra).

4. ábra A mikrotubulusok dinamikus instabilitására jellemző a növekedési és rövidülési fázisok közötti hirtelen átmenet. A rajz felső része több egyedi mikrotubulus viselkedéséből kapott átlagértékeket tünteti fel, alsó része egy kiválasztott mikrotubulus változásait szemlélteti az idő függvényében.
Ezek a hirtelen váltások a “gyors” végeken játszódnak le (a “lassú” végek in vivo általában zártak, l. alább). A váltások oka a tubulin polimerizációhoz kapcsolt GTP-áz aktivitása: a heterodimer alegységén levő GTP, a cső végére való rápülést követően lebomlik GDP-re és foszfátra. Ez szerkezeti változást okoz, a GTP-töltött dimer egyenes, míg a GDP tartamú görbült formájú (5.ábra).

5. ábra A nukleotid hidrolízis megváltoztatja a dimér szerkezetét: a GTP-vel feltöltött dimér egyenes, a GDP-töltött forma görbült, ami megnehezíti a laterális kapcsolatok kialakítását. A rajz két-két dimért ábrázol, a narancssárga és piros vonalak jelzik az elhajlást.
Az elöbbi kedvez a protofilamentumok közötti laterális kapcsolatok kialakulásához, az utóbbi kedvezőtlen. Ezért, ha a GTP-tartalmú dimerek asszociációja gyorsabb, mint az ezt követő GTP-hidrolízis, a csővégeken GTP-tartalmú egyenes dimerekből álló „sapka” alakul ki, mely stabilizálja a mikrotubulust. Ha a ráépülés lelassul (pl. a GTP-tartalmú dimerkoncentráció lokális csökkenése miatt), ez a sapka eltűnhet, a csővégeken a hidrolízis következtében GDP-tartalmú görbült dimerek jelennek meg, a protofilamentumok kigöndörödnek és ez azonnali depolimerizációt eredményez( 6.ábra).

6. ábra A mikrotubulusok dinamikus instabilitása abban nyilvánul meg, hogy végeik növedési fázisból hirtelen, véletlenszerűen átváltanak szétesésbe (katasztrófa), majd újra növekedni kezdenek (menkülés). Az instabilitás oka a polimerizációhoz kapcsolt GTP hidrolízis, mely megváltoztatja a dimerek szerkezetét. A GTP-töltött dimerekből egyenes protofilamentumok képződnek, melyek között erős laterális kapcsolat jön létre. A GDP tartalmú dimerek görbültek, nehezen létesítenek laterális kapcsolatot. Ezért, ha GDP tartalmú dimerek kerülnek a protofilamentumok végére, azok elkezdenek kifelé göndörödni és a mikrotubulus rohamosan rövidül. A szétesés következtében nő a szabad dimer koncentráció, ezt GDP/GTP kicserélődés követi, és újra a polimerizációnak kedvező feltételek alakulnak ki, megindul a cső növekedése (Alberts és munkatársai nyomán).
A dinamikus instabilitás következményeként a sejt mikrotubuláris apparátusa folyamatosan átépül: a sejt energiát (GTP-t) használ fel arra, hogy a rendszert állandóan átalakulásra kész állapotban tartsa. Különösen gyors a mikrotubuláris apparátus átrendeződése az osztódó sejtekben, melyekben a kromoszómák szállítását a mikrotubulusokból álló magorsó végzi . Az osztódás gátlására széleskörűen alkalmazott citosztatikumok jelentős része tulajdonképpen a dinamikus instabilitás megzavarásán keresztül fejti ki hatását.
Élő sejtben a mikrotubulusok viselkedését számos járulékos fehérje befolyásolja. Egyik csoportjuk - a MAP-k (mikrotubulushoz asszociált proteinek)- , melyek különösen nagy mennyiségben találhatók idegsejtekben (7.ábra).

7. ábra A struktúra-stabilizáló MAP-k típusai és szerkezete (Lodish és munkatársai nyomán)
A MAP-k hosszú, szálszerű molekulák, melyek a mikrotubulusok oldalához kötődve kilógnak azok felületéről, csökkentik a katasztrófák gyakoriságát, stabilizálják és kötegekbe rendezik a mikrotubulusokat(8.ábra).
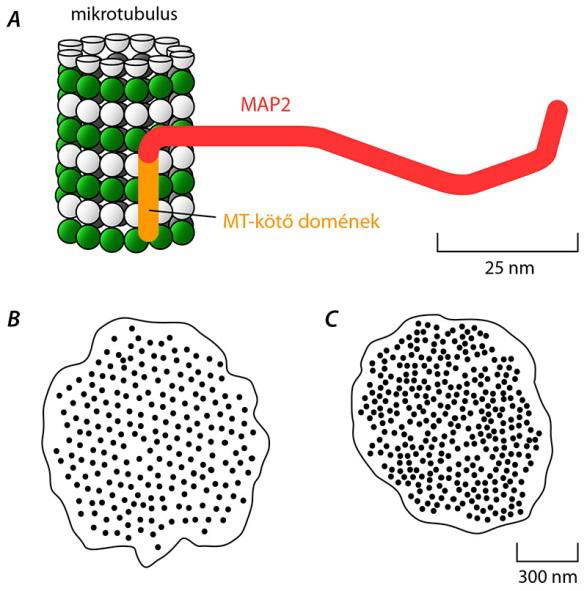
8. ábra (A) A MAP2 hosszú pálcikaszerű molekula. C-terminális régiója a mikrotubulus oldalhoz kötődik, N-terminális projekciós doménje kilóg annak felszínéről. (B) Elektronmikroszkópos felvétel alapján készült rajz MAP2-t túltermelő sejt nyúlványáról. A MAP2 kötegekbe rendezi a mikrotubulusokat és távtartóként megszabja a szomszédos mikrotubulusok közötti távolságot. (C) A tau rövidebb, mint a MAP2, ezért taut túltermelő sejtek nyúlványaiban a mikrotubulusok közötti távolság is rövidebb. (Alberts és munkatársai nyomán, módosítva).
Továbbá, a MAP-ok képesek megkötni, és ezáltal a mikrotubulus közelében rögzíteni más fehérjéket, így különböző enzimeket is. Ezáltal az egyes mikrotubulusok körül sajátos mikrokörnyezet alakul ki. Egyes MAP-k hibás müködése a mikrotubuláris hálózat összeomlásához és az érintett sejt pusztulásához vezethet. Pédául az Alzheimer kórban megfigyelhető neuron degeneráció jellegzetes tünete egy MAP (a tau fehérje) hiperfoszforilációja és abnormális aggregációja. A járulékos fehérjék más csoportjai gátolják a polimerizációt, destabilizáló hatásúak. Így, a stathmin szekvesztráló fehérje: αβ hetrodiméreket köt, ezáltal csökkentve a polimerizációhoz szükséges szabad dimer koncetrációt, a kinezin13 – egy motorfehérje – (l. alább) növeli a katasztrófák gyakoriságát, a katanin – egy ATP-áz – tördeli a mikrotubulusokat.
Fontos szerepe van a mikrotubuláris hálózat kialakításában a tubulinnak. A
tubulin nukleáló fehérje: néhány más fehérjével együtt hajlamos gyűrű formájú 10-13 egységből álló oligomerekbe - gyürű komplexekbe - szerveződni. Ezekhez asszociálódnak az α/β tubulin heterodimerek, és így a gyürűből fokozatosan egy mikrotubulus tud kinőni ( 9. ábra).

9. ábra A mikrotubulus nukleáció. A gamma-tubulin (piros) néhány más járulékos fehérjéhez (kék) kapcsolódva gyűrű-alakú komplexekbe (gamma-tubulin ring complex –TuRC ) szerveződik. A gamma-tubulin alegységekhez azután végeikkel (fehér körök) heterodimerek asszciálódnak. Ezért nukleáló hatása mellett a komplex egyben a képződő mikrotubulus “minusz” végét is lezárja, továbbá, a gyűrűt alkotó alegységek száma meghatározza a protofilamentumok számát is.
A 13 asszociációra lehetőséget adó hely meghatározza a protofilamentumok számát, az a tény pedig, hogy a heterodimerek alegységeikkel – azaz “minusz” végeikkel - kapcsolódnak a gyürűhöz, a mikrotubulus polaritását. A gyürű komplex egyben le is zárja, stabilizálja a keletkező mikrotubulus “minusz” végét.