Az aktin váz vékony, kb. 7nm átmérőjű, váltakozó hosszúságú fonalak ( mikrofilamentumok) citoplazmatikus hálózata(20.ábra).
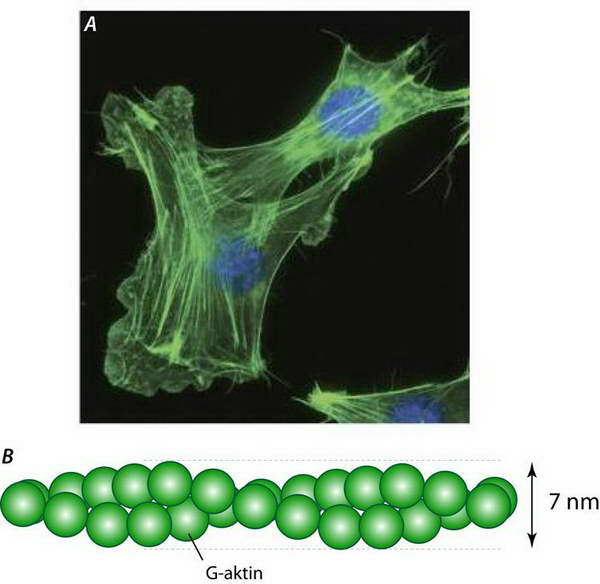
20. ábra A) Az aktin-hálózat(zöld, sejtmag – kék) kimutatása immunfestéssel (NIH 3T3, egér embrionális fibroblaszt sejtek); B) az aktinszál vázlatos szerkezete. Az A) ábra forrása:
A fonalak az aktin fehérje polimerjei. Az aktin monomer (G-aktin) globuláris szerkezetű, 375-377 aminosavból álló, minden sejtben nagy mennyiségben előforduló fehérje, melynek α, β és izoformái ismertek (21. Ábra).

21. ábra Egér aktin szekvenciák. Az egyes izoformák szekvenciái között kevés az eltérés, ezeket a piros jel emeli ki.
Az α-aktin izomsejtekre jellemző, míg a β és izoforma egyéb sejtekben expresszálódik. A G-aktin kb.5x5x3.5nm méretű, kissé ellapított molekula, egyik oldalán egy bemélyedésel, ez a nukleotid (ATP, vagy ADP) kötő zseb. Jelenléte miatt a molekulán négy szubdomén különíthető el (22.ábra).
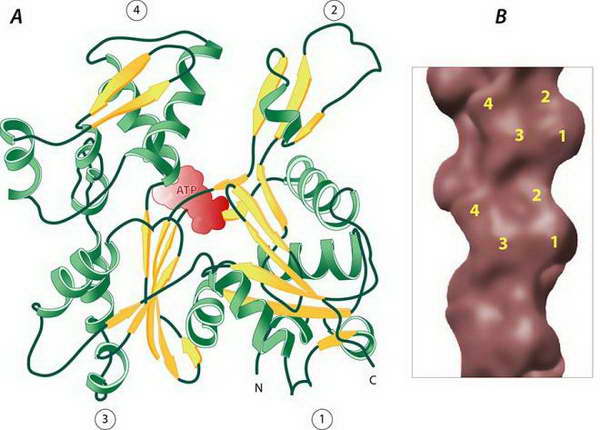
22. ábra (A) A G-aktin szerkezete, szalag modell. A molekula négy szubdoménre osztható, a második és negyedik között helyezkedik el a nukleotidkötő zseb. (B) G-aktinok elhelyezkedése az aktinszálban: térszerkezeti modell (a számok a szubdoméneket jelölik).
A polimerizáció során az aktin monomerek azonos orientációban kapcsolódnak egymáshoz, ezért a keletkező fonal (F-aktin) polarizált szerkezetű: egyik végén az utolsónak beépült monomer nukleotid-kötő zsebe néz kifelé, míg másik végén a szélső monomer zsebbel ellentétes oldala van szabadon. Az előbbi a polimer “lassú”, vagy “minusz” vége, az utóbbi a “gyors” vagy “plusz” vég. A fonalban az aktin monomerek egymáshoz képest kissé elcsúszva és elfordulva kacsolódnak össze, ezért az F-aktin két egymásköré fonódó gyöngysorszerű szálként írható le, ahol a szálak kereszteződési pontjai 36-37nm távolságra vannak egymástól (23.ábra)
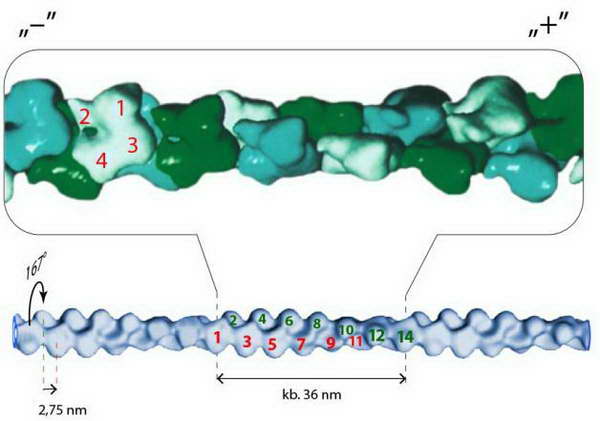
23. ábra Az F-aktinban a monomerek egymáshoz képest kb. 2.75 nm-el elcsúszva, és 1670-al elfordulva kapcsolódnak egymáshoz, ezért az F-aktin két egymás köré tekeredő szálként írható le. A két szál keresztezési pontjai kb. 36nm-re vannak egymástól, két keresztezési pont között kb. 13-14 monomer helyezkedik el.
A polimerizáció kezdő lépése a nukleáció: néhány monomer összekapcsolódik oligomerré (mag). A nukleációs magok instabil struktúrák, könnyen szétesnek, ezért kémcsőben a nukleáció viszonylag lassú folyamat. Élő sejtben ezt a lépést nukleáló fehérjék szabályozzák (l. később). A nukleációt követi az elongációs fázis: az oligomerek végeihez újabb és újabb ATP-vel töltött G-aktin monomerek kapcsolódnak. Beépülésüket némi késéssel követően az ATP ADP-vé hidrolizál, ezért a szál belsejében levő monomerek nukleotid kötő zsebében már ADP van. A növekedés addig tart, amíg a szabad ATP –töltött G-aktin mennyisége eléri a kritikus koncentrácíót. A szál szerkezeti polarizáltsága miatt azonban a kritikus koncentráció a két végen nem egyforma, a “minusz” végen nagyobb, mint a”plusz”végen. Ezért előállhat olyan állapot, mikor a “plusz” vég még növekszik, miközben a”minusz” vég már fogy és exponálódnak az ADP-töltött monomerek, melyek disszociációra hajlamosak. Kialakul egy sajátságos mókuskerék állapot, melyre az jellemző, hogy időegység alatt a “plusz” végre annyi ATP-töltött monomer asszociálódik, mint amennyi ADP-aktin monomer a”minusz” végről leválik: a szál ATP fogyasztása közben folyamatosan átépül, miközben tömege/hossza nem változik (24.ábra).
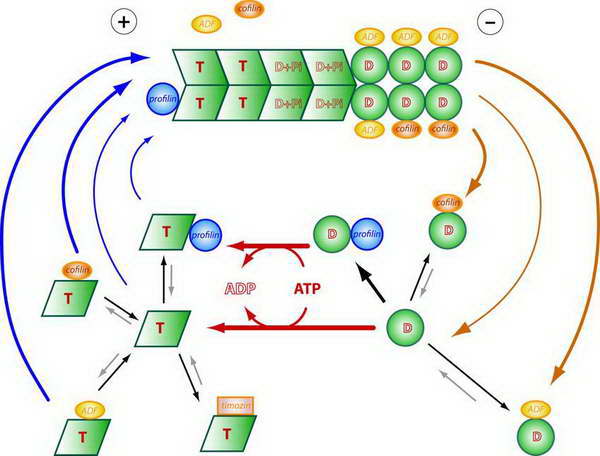
24. ábra Az F-aktin polimerizációja: a mókuskerék (taposómalom) állapot vázlata. Az aktinszál két vége a nukleotidkötő zseb aszimmetrikus elhelyezkedése miatt nem egyforma (l. szöveg). Az ATP-vel feltöltött G-aktin (T) kritikus koncentrációja a “plusz” végen alacsonyabb, mint a “minusz” végen. Ezért ebben a koncentráció tartományban a “plusz” végre még lehetséges a ráépülés, a “minusz“ végre már nem. A T formán a beépülést követően az ATP elhidrolizál, ezért a szál belsejében és végén már ADP.Pi (D+Pi), illetve ADP (D) tartalmú G-aktin monomerek vannak, melyek hajlamosak a szálról leválni. Ezt követően újra feltöltődnek ATP-vel (D->T) és a ciklus ismétlődik. Mókuskerék állapotban időegység alatt annyi T épül rá a “plusz” végre, amennyi D leválik a “minusz” végről: a szál hossza nem változik, miközben folyamatosan átépül. A körforgást járulékos fehérjék befolyásolják. A cofilin és az ADF (aktin-depolimerizáló-faktor) felgyorsitják a D formák leválását a “minusz” végről, a profilin felgyorsítja a D->T konverziót és prezentálja a T formát a “plusz” végnek. Együttes hatásukra a körforgás jelentősen felgyorsul. Más fehérjék, pl. a timozin (T4) lekötik a T formát és így lassítják a körfogást.
Az aktin polimerizációt, a folyamat dinamikáját (lassítását/gyorsítását), a filamentumok hosszát, térbeli eoszlását, stabilitását számos járulékos fehérje biztosítja (25.ábra).
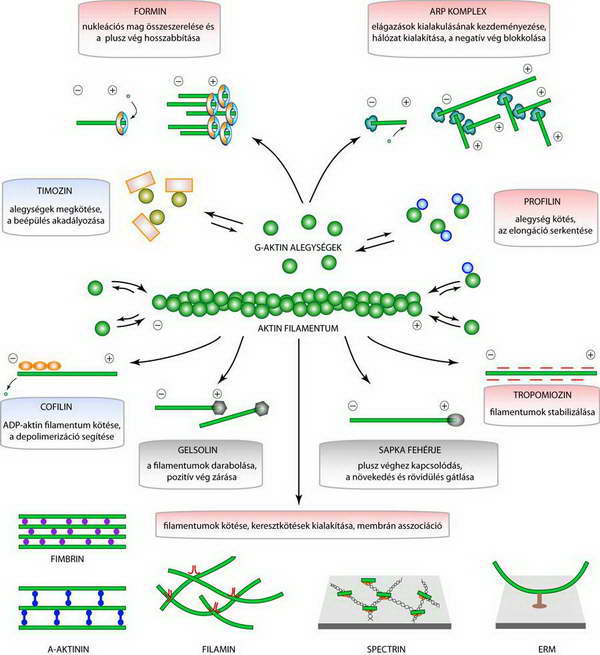
25. ábra Az aktin polimerizációt és az aktinszálak térbeli eloszlását szabályozó járulékos fehérjék tipusai és jellegzetes képviselői (Alberts és munkatársai nyomán módosítva).
A polimerizáció kritikus lépése a nukleáció. A sejtekben ez a lépés specifikus fehérjék, nukleáló faktorok közreműködésével történik. A mikrotubuláris hálózattól eltérően, ezek nem tömörülnek egységes organizáló központba, hanem változatos helyeken, legtöbbször a plazmamembrán alatt, a sejt kortikális régiójában lokalizálódnak. Egyik jellegzetes képviselőjük az ARP komplex (actin-related protein), mely két aktinszerű fehérjéből és az őket összekapcsoló néhány járulékos fehérjéből áll. A két aktinszerű taghoz G-aktin monomerek kapcsolódhatnak és mivel az aktinszerű fehérjék rögzítettek, stabil mag alakul ki, melyről könnyen megindul a szálnövekedés. A komplex az újonnan kialakuló szál “minusz” végén helyezkedik el. Az ARP komplex hajlamos már létező filamentumok oldalához asszociálódni és innen indítani új szálak polimerizációját. Ezek kb. 700-s szögben helyezkednek el az anyaszálhoz képest és így faágszerű aktinhálózat alakul ki (26.ábra).
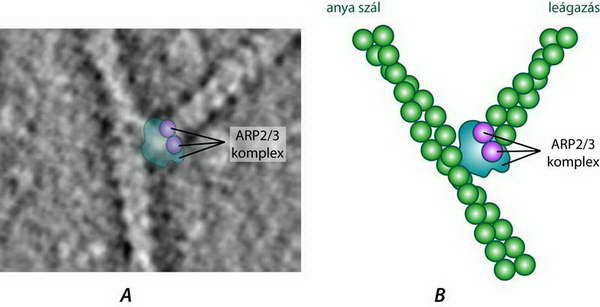
26. ábra Dendritikus aktinhálózat részlete. (A) elektronmikrószkópos kép; (B) az elágazás szerkezete.
A dendritikus aktinhálózat jellemzően a mozgó sejtek kitüremkedő, lemezszerű nyulványaiban (lamellipodiumaiban) figyelhető meg (l. később). Egy másik nukleáló és szál-hosszabbító fehérje a formin, mely dimereket alkot. A dimer mindkét tagja egy-egy G-aktin monomert tud megkötni és így stabil nukleációs mag alkul ki, melyhez újabb és újabb aktin monomerek assszociálódnak, megindul a szál hosszabbodás(27.ábra).
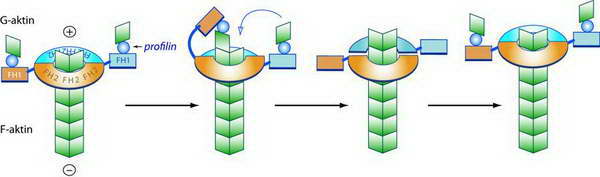
27. ábra A forminok “plusz” vég nukleáló/szálhosszabbító működése. A formin dimerek (barna és kék) FH1 (formin homológia 1) doménjei ATP-töltött G-aktin/profilin komplexeket tudnak megkötni. A dimerek FH2 doménjei gyűrűt alkotnak az aktinszál “plusz” vége körül. Ezután az FH1 domén a szál véghez hajol és ráülteti a G-aktin monomert, majd a ciklus ismétlődik.
Az ARP komplextől eltérően az elongáció során a formin dimérek végig a szál “plusz” végén ülnek és általában nem faágszerű aktin hálót hoznak létre, hanem hosszú, párhuzamosan elhelyezkedő aktin nyalábokat Ilyenek merevítik ki a sejtek tüskeszerű állábait, a filopodiumokat.
Mindkét nukleáló fehérje aktivitását a monomer GTP-ázok (kis G-fehérjék) egyik családjának, a Rho GTP-ázoknak tagjai szabályozzák ( a kis GTP-ázok GTP-t tudnak megkötni, illetve hidrolizálni. GTP-kötött formájukban számos más fehérjét aktiválnak, GDP-kötött állapotban inaktívak). A forminok szabályozása direkt: a molekulákon Rho-kötőhely van és nukleálni csak Rho-kötött állapotban képesek. Az ARP komplex aktiválása összetettebb folyamat. Ez egy sajátságos molekula, a WASP (Wiskott-Aldrich syndrome protein) közreműködésével történik (28.ábra).

28. ábra A WASP szerkezete. A molekula több más fehérjével és membrán lipiddel képes kapcsolatot létesíteni. Aktivitását Rho-tipusú kis G-fehérjék (pl. Cdc42) szabályozzák, melyek a molekula GBD/CRIB (G-protei binding domain) doménjéhez kötődnek. Más domének (WH1 és Basic) a plazmamembrán foszfatidil-inozitol molekuláihoz (PtdIns(4.5)P2) kapcsolják a WASP-ot, tehát kijelölik kortikális lokalizációját . A C-terminális régió (Pro-rich, V, C, A) profilint, aktint, és ARP komplexet köt. A WASP ezáltal integrátorként működik: egy adott jelre a megfelelő helyen összehozza az aktin polimerizációhoz szükséges összes partnert.
A molekula alapállapotban inaktív, de Rho tipusú kis G-fehérje bekötésére aktiválódik. Az aktiv WASP képes ARP-komplex és G-aktin egyidejű megkötésére, tehát “összehozza” a polimerizáció szereplőit és megindulhat a dendritikus aktin hálózat kialakulása(29 Ábra).
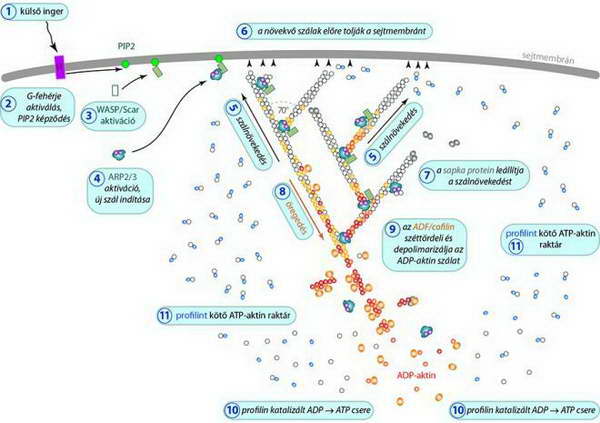
29. ábra A dendritikus aktinhálózat kialakulása (Pollard és Borisy nyomán módosítva). A polimerizáció külső jel (pl.kemotaktikus molekulák) hatására indul be, kis G-fehérjék aktiválják a WASP/ARP rendszert, megindul a szálnövekedés, melyet a “plusz” végre ülő végstabilizáló fehérjék (sapka proteinek) korlátoznak. A szálak ADP-aktint tartalmazó “minusz” végei cofilin hatására depolimerizálódnak, profilin közreműködésével megtörténik a szabad G-aktin feltöltése ATP-vel és a ciklus ismétlődik.
A polimerizáció szabályozásában jelentős szerepe van a szekvesztráló fehérjéknek, melyek a G-aktin monomerek egy részét kötve tartják, csökkentve ezáltal a polimerizációhoz szükséges szabad monomer koncentrációt. Jellegzetes képviselőjük a timozin. Egy másik monomer kötő fehérje a profilin, mely szekvesztráló hatása mellett elősegíti az ADP/ATP kicserélődést az aktin monomereken és prezentálja az ATP-vel feltöltött monomert a szál “plusz” végének. A szálak végeinek viselkedését végstabilizáló fehérjék befolyásolják. Ezek lezárják a szálak végeit megakadályozva a további növekedésüket, vagy szétesésüket. Ismerünk “plusz” és “ minusz”és vég záró fehérjéket. A mikrofilamentumok hosszát a fragmentáló fehérjék is befolyásolják, melyek rövid darabokra tördelik a szálakat. Jellegzetes képviselőjük a gelszolin. Ismerünk destabilizáló fehérjéket is. Ilyen a cofilin, mely preferáltan az ADP-töltött aktinhoz kötődik és felgyorsítja ennek leválását a szál “minusz” végéről. Cofilin és profilin kombinált hatása a “taposómalom” felgyorsulásához vezet (24.ábra). A mikrofilamentumok térbeli elhelyezkedését a keresztkötő fehérjék nagy csoportja befolyásolja. Ez utóbbiak hosszú, pálcikaszerű molekulák, végeiken aktinkötő régióval. Egyesek közülük párhuzamos nyalábokba, kötegekbe rendezik, mások laza térhálóba szervezik a szálakat. Egy további csoportjuk a filamentumokat a plazmamembránhoz kapcsolja (25.ábra).
A járulékos fehérjék különböző kombinációinak alkalmazásával a sejt az aktin polimerből képes viszonylag statikus, merev, nyalábokba rendezett strukturát kialakítani (pl. a mikrobolyhokat kimerevítő aktin köteg), de létre tud hozni laza, gyorsan átépülő hálózatot is (pl. dendritkus hálózat a mozgó sejt állábaiban).