Általában azt mondhatjuk, hogy a rekombináns DNS technika forradalmasította a receptorok és a szignalizációban részt vevő fehérjék vizsgálatát, hiszen e molekulák legfeljebb a sejt teljes fehérjetartalmának 0,01%-át teszik ki, így a hagyományos biokémiai, fehérje analitikai módszerekkel csak nagyon nehezen voltak megközelíthetők, analizálhatók.
A vízben oldódó, kiesebb-nagyobb méretű szignálmolekulák (fehérje természetű hormonok, növekedési faktorok) a sejtfelszínen levő receptoraikhoz kötődnek. A receptorok maguk nem csak nagy affinitással kötik a ligandjaikat, hanem szignál transzducerként (jelátvivőként) is működnek, képesek a jelmolekula kötődését értelmezni és konvertálni intracelluláris jellé, ami aztán megváltoztatja a célsejtek működését. A legtöbb sejtfelszíni receptor besorolható három fő kategóriába, attól függően, hogy milyen transzdukciós mechanizmus szerint működik.
Az ioncsatornához kötött receptorok (transzmitter-gated ion chanels) a gyors, szinaptikus jelátvitelben szerepelnek elsősorban. A neurotranszmitter köt a receptorához és ez a kötődés nyitja (vagy zárja) a receptort, azaz átengedi (vagy éppen meggátolja) az ionok áramlását a sejt közötti térből a sejtbe. A receptor ilyenkor tehát úgy működik, mint egy ioncsatorna, hypo- vagy hyperpolarizálja a sejtet. Erről a jelátviteli típusról elsősorban az idegélettan keretében lesz szó.
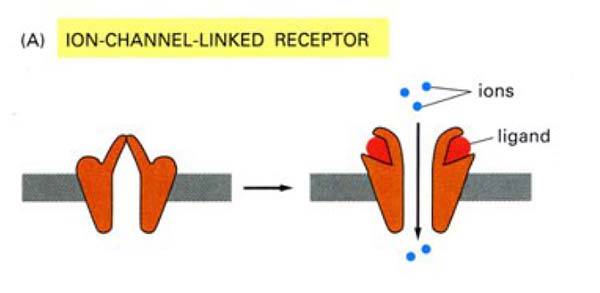
10. ábra Az ioncsatornához kötött receptor működése
A G-protein kapcsolt receptorok esetében a receptor és a célmolekula között egy „trimeric GTP-binding regulatory protein” (ún. G-protein) közvetíti a jelet. A jelmolekula maga egy sejtfelszíni receptorhoz köt, ez aktiválja a G-proteint, majd az aktivált G-protein köt egy szintén sejfelszíni célmolekulához, ami lehet pl. egy ioncsatorna, vagy egy enzimműködésű fehérje.
A G-fehérjékhez asszociált receptorok ligandjai általában a hormontermelő szervekben termelődő hatóanyagok, a szöveti hormonok és egyes érzékszervekre ható anyagok lehetnek. Ilyenek például az adrenalin és noradrenalin, az ACTH, STH, szomatosztatin, FSH, LH, TSH, LTH, MSH, a releasing hormonok, a glukagon, a dopamin, a hisztamin és a szerotonin, a prosztaglandin és a leucotrien, egyes szaganyagok, savanyú, keserű ízérzést okozó molekulák.
Valamennyi G-protein kapcsolt receptor egy molekulacsaládba tartozik és szerkezetük erősen hasonlít egymáshoz. Van rajtuk (természetesen) egy extracelluláris ligand-kötő hely, továbbá hét transzmembrán domain, intracellulárisan pedig egy (vagy két) G-protein kötő, és több foszforilációs hely. Ez utóbbiak a receptor érzékenységét határozzák meg.
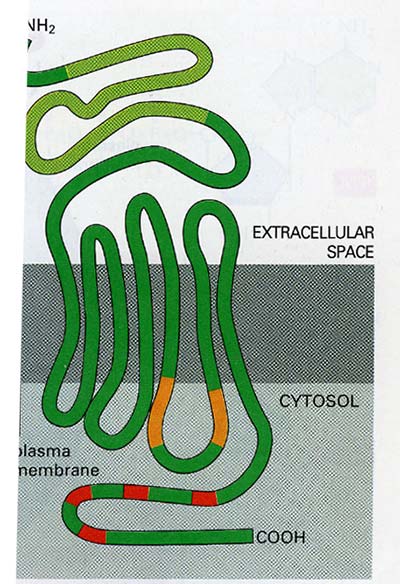
11. ábra A G-protein kapcsolt receptor funkcionális egységei
A G-protein kapcsolt receptorok akkor aktiválódnak, amikor a jelmolekula (ligand) a receptorhoz kapcsolódik és az aktivációhoz szükséges konformációváltozást kiváltja. Ennek az a következménye, hogy a sejtmembránhoz kötött G-fehérje elmozdul és a receptorhoz kötődik. Ekkor a G-fehérjén a GDP kötés jelentősen meggyengül és a GDP GTP-re cserélődik. Utána a G-fehérje β és ɣ alegysége leválik az α alegységről és az α lánc felszínére kerül az adenylyl-cylase-(adenilcikláz-)kötő hely. A G-fehérje leválik a receptorról, aminek az a következménye, hogy a szignálmolekula lelép a receptor extracelluláris részéről, a G-fehérje α alegysége pedig az adenilciklázhoz kapcsolódik és aktiválja azt. Az aktivált adenilcikláz ATP-ből cAMP-t szintetizál, ami ezután egy foszforilácós kaszádon keresztül megindítja a sejtben a szignálmolekula által indukált specifikus működéseket. Közben a G-fehérje α alegységén a GTP hidrolizál és inaktiválódik. Így a molekula visszatér eredeti állapotába, azaz újra GDP-t fog kötni és hozzákapcsolódik a β és ɣ alegységeihez.

12. ábra A G-protein kapcsolt receptorokon keresztül történő jelátvitel lépései vázlatrajzon
A G-fehérjék a receptor-ligand kötés hatására nem csak az adenilciklázt aktiválhatják (mint fentebb láttuk), hanem a szintén a sejtmembránhoz kötött foszfolipáz C-t is. A foszfolipáz C működése következtében a PI 4,5-bifoszfátból (PIP2) részben diacylglycerol (diacilglicerol), részben inozitol 1,4,5-trifoszfát (IP3) keletkezik. A diacilglicerol a proteinkináz C-t (PKC) aktiválja. Az inozitol 1,4,5-trifoszfát pedig az endoplazmatikus retikulum Ca2+ raktáraiból felszabadítja a Ca2+ ionokat, amelyek specifikusan kötnek egyes fehérjékhez, ezáltal aktiválva őket. Ezen a szabályozási útvonalon szintén aktiválódhatnak a sejt specifikus működései. 13-14
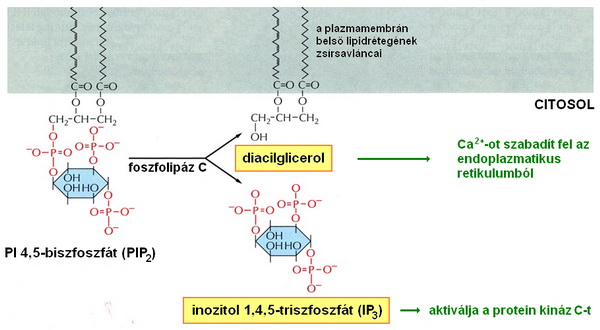
13. ábra A foszfolipáz C hatására diacilglicerol és IP3 keletkezik a sejtben
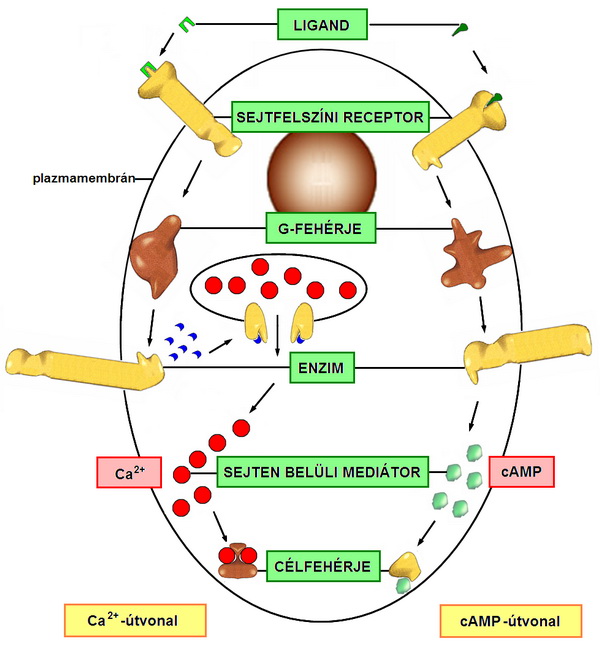
14. ábra A G-protein kapcsolt receptorok részben a cAMP, részben a Ca2+ koncentrációjának növelése útján serkentik a sejt specifikus funkcióit
A folyamat során keletkező diacilglicerol a PKC-t („C-kinázt”, foszfokináz-C-t) aktiválja, amely egyrészt foszforilálja a MAP-kinázokat. Az aktivált MAP-kináz a sejtmagba transzportálódik és az SRF-Elk-1 transzkripciós komplexet foszforilálja, amely specifikus gének átíródását serkenti. Másrészt az aktivált PKC felszabadítja a komplexéből az NF-κB-t, amely szintén belép a sejtmagba és ott meghatározott gének szabályozó régiójához kapcsolódva szintén azok átíródását serkenti. E két útvonalon tehát a a G-proteinhez kapcsolt receptorokon keresztül megvalósuló szignalizáció a génműködés szabályozásában is jelentős szerepet tud betölteni.
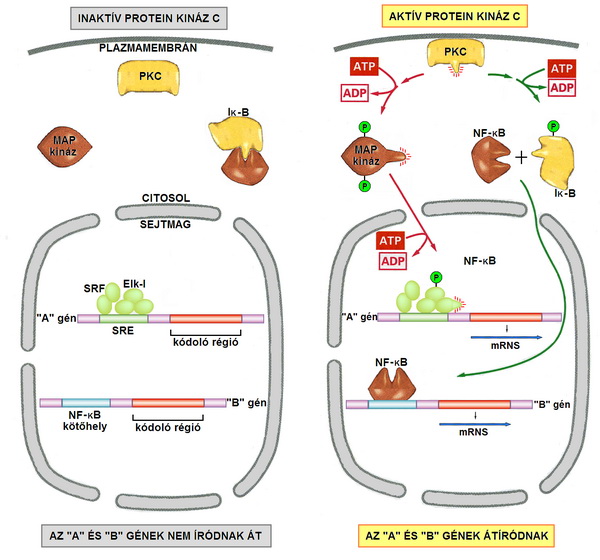
15. ábra A G-protein kapcsolt receptorok a MAP-kinázokon és az NF-κB-n keresztül a génmüködés szabályozásában is részt vesznek