Ezen receptorok elsősorban növekedési/differenciálódási faktorokat kötnek, mint pl. az EGF (epidermal growth faktor), PDGF (platellet derived growth factor), VEGF (vascular endothelial growth factor), IGF (insulin-like growth factor), NGF (nerve growth factor), FGF (fibroblast growth factor), HGF (hepatocyte growth factor), stb.. A receptor 1200 aminosavból épül fel. Extracelluláris, ligand-kötő része, erősen glikozilált. Egy transzmembrán domainje van. A receptor intracelluláris része tirozin-kináz aktivitással rendelkezik, ami akkor aktiválódik, ha a ligand hozzákötődik a molekulához. Ez pontosan úgy történik, hogy a jelmolekula kötődésnek hatására a tirozin-kináz receptorok dimerizálódnak. A dimer két intracelluláris része kölcsönösen foszforilálja egymást, mégpedig a tirozinjaikon, valamint más, specifikus célfehérjéket is foszforilálnak, szintén azon tirozinjain. Az autofoszforiláció fontosságát a folyamatban úgy igazolták, hogy olyan receptor mutánsokat generáltak, amelyeknek nincs kináz aktivitásuk, viszont dimerizációra képesek. A hibás receptort tartalmazó dimerek nem tudják egymást foszforilálni, ezért nem is tudnak működni, a jelátvitel gátolt ebben az esetben.

17. ábra A tirozin-kináz receptorok autofoszforilációja (A) és az autofoszforiláció szerepének kísérletes igazolása (B)
Az autofoszforiláción felül a tirozin specifikus protein kináz receptorok több, intracelluláris fehérjét képesek kötni, attól függően más-más fehérjéket, hogy aktuálisan milyen jelmolekula, növekedési faktor aktiválta őket. Ezen intracelluláris fehérjéket is foszforilálják a tirozinjaikon. Ezáltal aktiválják őket és így indukálnak specifikus funkciókat a célsejtben.

18. ábra A tirozin-kináz receptorok nem csak autofoszforilálják egymást, hanem a közvetlenül (A), vagy scaffold fehérjék közvetítésével hozzájuk kötődő citoplazmatikus fehérjéket is foszforilálnak, azokat is a tirozinjaikon

Lássunk erre egy konkrét példát. A Drosophila összetett szemében kb. 800 ommatidium van. Mindegyikben 8 fotoreceptor sejt (retinula sejt) található. Ezek az embrionális retina egyrétegű hámjából differenciálódnak, meghatározott sorrendben. Közülük az R7 sejtek alakulnak ki legkésőbb, amelyek az UV fény érzékelésére szolgálnak.

19. ábra A retinula sejtek differenciálódása a Drorophila szemében
A sevenless (sev) mutánsokban egy tirozin-specifikus protein-kináz receptor hiányzik, ami az R7 sejtekben fejeződik ki normálisan. Vannak olyan mutánsok is, amelyekben az R7 sejtek fejlődése zavart, de bennük sev expressziója és szerkezete normális. Ez aktiválja a sev fehérjét azokban a sejtekben, amelyek e kötés hatására R7 sejtekké differenciálódnak. Igazolható, hogy csak azokból a sejtekből lesz R7 sejt, amelyek közvetlenül kapcsolódnak az R8 sejtekhez és felszínükön létrejön a sev-boss kapcsolat. A kötés hatására a downstream receptor kináz, a son of sevenless-t (sos) kapcsolja a sev-hez, a sos pedig a Ras molekulákon a GDP-t GTP-re cseréli. Ezzel aktiválja őket. Az aktivált Ras fehérjék a sejtmagban specifikus gének aktivációját serkentik, ezzel beindítva a sejtek differenciálódását. Fontos, hogy a sos egyidejűleg gátolja a GTP-ase Activating Proteint (GAP), ezzel erősítve a jelet a sejtben. Az ilyen típusú jelátviteli mechanizmus feltehetően eléggé általános, de ma még csak kevés kísérletesen is igazolt ilyen példát ismerünk.
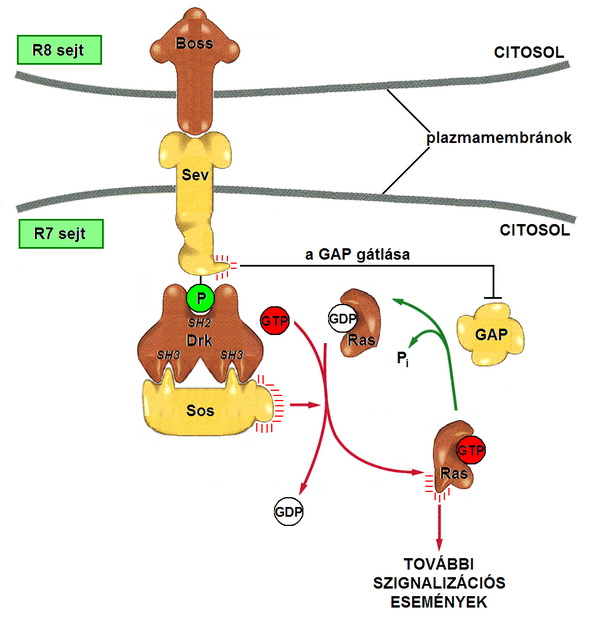
20. ábra A sevenless jelátviteli útvonal a Drosophila retinula sejtjei között