Nézzük először a cadherinekre vonatkozó, legfőbb ismereteket. Az első három cadherin molekulát aszerint nevezték el, hogy milyen szövetből izolálták őket. Az E-cadherin a legtöbb epithelialis sejtben megtalálható. Az N-cadherin az idegsejtekben (és az izom és a szemlencse sejtjeiben) fordul elő. A P-cadherint eredetileg a placentából izolálták, de más szövetekből is kimutatták. Ma már legalább 12 féle cadherint ismerünk. A feltételezések szerint minden sejttípus legalább egy, de inkább több cadherint fejez ki, ezeket a sejtmembránba transzportálja. A cadherinek jellemző kombinációja az, ami meghatározza, hogy az adott sejt milyen más sejtekkel, sejttípusokkal képes kapcsolatot teremteni, milyen sejtekkel tömörül egy szöveti együttesbe.
Számos in vivo és in vitro kísérlet bizonyítja, hogy az embrionális szövetekben elsősorban a cadherinek tartják össze a sejteket. Ha a Ca2+ ionokat kivonják a környezetből, vagy anti-cadherin kezelést alkalmaznak, az embrionális szövetek sejtekre hullanak szét. Következésképp, ha a cadherinek nem működnek, a többi sejtadhéziós molekula nem képes a sejteket összetartani. Ugyanezt bizonyítják a genetikai kísérletek is. A cadherin mutánsok az embriogenezis egész korai időszakában szétesnek sejtekre, ill. nem is képesek egymáshoz kapcsolódni.
Az embriogenezis során először az E-cadherin jelenik meg, emlősökben a 8-16 sejtes állapotban. Az eddig a fejlődési állapotig csak lazán egymáshoz nyomódó sejtek (blastomerák) szorosan egymáshoz kapcsolódnak, amit egyszerű mikroszkópos megfigyeléssel is jól fel lehet ismerni, ugyanis az embrió kisebb lesz és a sejtjei szorosan egymáshoz simulnak. Ez a compactio jelensége.
A legtöbb cadherin molekula transzmembrán glikoprotein, amely 700-750 aminosavból épül fel. Az extracelluláris része öt darab, nagyjából 100-100 aminosav hosszúságú funkcionális egységből (domain) áll. Közülük négy gyakorlatilag azonos felépítésű és rendelkezik Ca2+ kötőhellyel. Ha nincs a közegben kalcium ion, akkor ezek a domain-ek súlyos konformáció változást szenvednek és egy bizonyos idő elteltével le is bomlanak. Az extracelluláris domain-ek közül a legtávolabbi, legkülső hordoz egy His-Ala-Val aminosav szekvenciát, ami a sejt-sejt kapcsolatért elsősorban felelős. Ha ezt a részt, vagy ebből egy aminosavat kivágnak, vagy kicserélnek akkor a molekula elveszíti a fiziológiai funkcióját: nem képes a sejtek közötti kapcsolatot létrehozni. A molekula intracelluláris része cateninekhez (és más fehérjékhez) kapcsolódik, ami(k) a citoszkeletalis actinhoz kötik a cadherin molekulák citoplazmatikus „farkát”.
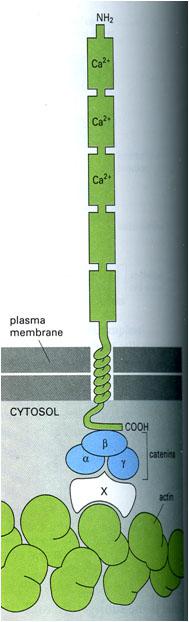
3. ábra A cadherin molekula domain szerkezete
A cadherinek egymáshoz ún. homophyl módon kapcsolódnak. Ez azt jelenti, hogy a kapcsolódáshoz más molekula nem kell, csak a két külön sejten elhelyezkedő két cadherin. Ezek a legdisztálisabb szerkezeti elemeikkel képesek egymáshoz kapcsolódni és a két sejtet egymáshoz kötni. Ezt elegáns kísérleti rendszerben is bizonyították. L-fibroblasztokon dolgoztak, amelyek felszínén egyáltalán nincsenek cadherinek, ezért nem is kapcsolódnak egymáshoz. Ha azonban E-cadherint kódoló DNS-sel transzfektálták a sejteket, akkor azok Ca2+ jelenlétében egymáshoz kapcsolódtak. Tehát a kapcsolódás kialakulásához elegendő csak az E-cadherin, más molekula jelenléte nem kell hozzá. Természetesen a transzfektált L-fibroblasztok a nem transzfektáltakkal nem asszociálódnak. Ugyanebben a kísérleti rendszerben az is igazolható, hogy ha egyes sejteket E-cadherinnel, másokat P-cadherinnel transzfektálnak, akkor a két sejtcsoport csak a vele azonos cadherint expresszálókkal teremt kapcsolatot, a másikkal nem.
Ha cadherinek citoplazmatikus részét levágják, akkor azok nem tudnak a cateninekhez, ill. a citoszkeletális actinvázhoz kapcsolódni és a sejt-sejt kapcsolat így nem tud normálisan működni.
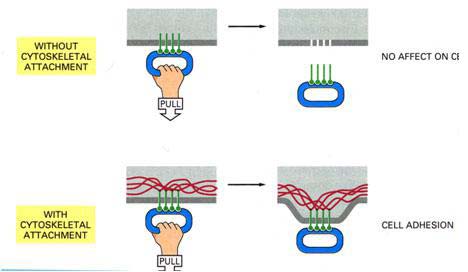
4. ábra A sejtkapcsoló fehérjék a sejtvázhoz való kapcsolat hiányában nem tudják fiziológiai funkciójukat ellátni.
Megjegyzendő, hogy a desmosomák területén is cadherinek tartják össze a két sejtet, de a desmosomák a sejten belül nem az actinvázhoz, hanem intermedier filamentumokhoz asszociálódnak.
A cadherinekhez hasonló szerkezetű selectinek az endothel sejtekben fejeződnek ki, sérüléseket követően. Ezek a molekulák a fehérvérsejteken levő lectinekhez kapcsolódnak (heterophyl mechanizmussal) és megkötik őket a sérülés helyén, ahol a funkciójukat el tudják látni.