A makromolekulák sérülése, a stresszor típusától függetlenül, mindig a folyamat első lépésnek tekinthető. Ezért alapvető fontosságú a szenzorok jelenléte és megfelelő működése. A szignál transzdukciós rendszer három felépítő eleme: szenzor – transzduktor – effektor. A kezdeti lépéseket követően a szenzor-fehérjék aktívak maradnak. Ez az aktivitási periódus faj és sejttípus specifikus, függ a génkörnyezettől, az adott stressz erősségétől és gyakoriságától. Tulajdonképpen ez adja meg a sejt stressz toleranciáját. A kereszt tolerancia emelkedett tolerancia egy stresszre, más stresszorral történt prekondícionálást követően. Stressz „hardening” (stressz-indukált edzés) pedig emelkedett tolerancia egy stresszre, azonos, de alacsony dózisú stresszorral történt prekondícionálást követően. A lipid-sérülés szenzorok változatos módon érzékelik a membrán sérüléseit.
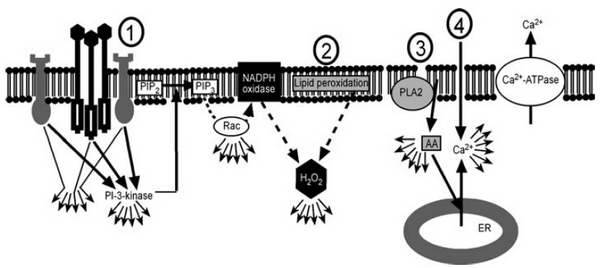
3. ábra. A sejtmembrán sérülések érzékelési lehetőségei. Kultz, D. (2005). "Molecular and evolutionary basis of the cellular stress response." Annu Rev Physiol 67: 225-57.
A sejtmembrán alapvető barrier a sejt számára, ezért épségének állandó monitorozása kiemelkedő fontossággal bír. Ennek megfelelően sok mechanizmus dolgozik a kisebb-nagyobb sérülések felismerésén, amelynek gyorsasága és pontossága elengedhetetlen a regenerációt végző enzimek számára. Elsősorban a membrán biofizikai paramétereinek változása aktiválja a szenzor mechanizmusokat. 1. membrán fehérjék átrendeződése miatt receptor csoportosulás alakul ki (ún. clustering). Ez elsősorban a nem-specifikus növekedési faktorok és citokin receptorok esetében intracelluláris kaszkádot indít (IP3-kináz, second messenger). Ozmotikus és UV-indukált stressznél jellemző elsősorban. 2. A direkt lipid peroxidáció hidrogén-peroxid képződéshez vezet, amely az oxidatív stressz indukciós molekulája. Az ábráról leolvasható az 1. és 2. folyamat közti kapcsolat is. 3. A membrán tenzió változása integráns fehérjék konformáció változását okozza, amely arachidonsav felszabadításhoz vezet, amely szintén fontos intracelluláris second messenger molekula. 4. A membrán permeabilitásának változása Ca2+ beáramlást eredményez, ezáltal emelkedik az intracelluláris Ca2+ koncentráció, amely számtalan sejtfunkció mediátoraként ismert. Megjegyzendő, hogy a Ca-ATPáz tagja a MSP-nak. Szükséges pl. az intracelluláris Ca2+ koncentráció sejtválaszt követő regenerációjában (ti. az emelkedett Ca2+ - szint miatt kialakuló citotoxicitás elkerülése). A DNS-sérülés szenzorok esetében a többszörösen összetett komplexek és szabályzókörök jelenléte miatt meglehetősen nehéz a szenzorok és a transzducerek szétválasztása. A felismerési pontokat a többi szenzor számára a topoizomeráz I/III enzim végzi, egyes szálú törések inszerciójával. Ezeket a pontokat ismeri fel a MSH/MLH/Rad51 komplex.
Stresszortól függetlenül a CSR együtt jár a celluláris redox állapot változásával. Egyes vizsgálatok szerint egyenesen a CSR egyik fő kiváltó tényezőjének tekinthető. A folyamat fontosságának hangsúlyozásához meg kell jegyeznünk, hogy a redox folyamatokért elsősorban felelős mitokondriumra is jellemző egyfajta stressz válasz, amelyet mitokondriális stressz response-nak nevezünk (MSR). Habár a mitokondrium több szempontból is (önálló DNS, pH, szabályzó folyamatok) szeparált sejtalkotó, homeosztázisa azonban alapvető a sejt egésze szempontjából. A MSR során az organellumból érkező szignálok ugyanis képesek aktiválni a CSR-t exogén stimulus hiányában is! Minden sejt rendelkezik regenerációs apparátussal oxidatív sérülésre (pl. aszkorbinsav, glutation, thioredoxin, stb.). A minimális stressz proteomhoz tartozó oxidoreduktázok, mint az alapanyagcsere dehidrogenázai, stresszmentes állapotban is esszenciálisak. A redox potenciál változásait elsősorban a reaktív oxigén/nitrogén gyök (ROS/RNS) szintjének emelkedése jelzi a CSR felé. Így az emelkedett ROS optimális a stressz szenzorok és a CSR szignalizáció számára, de egyben halálos a sejt szempontjából. Ebből kifolyólag a sejt számára elengedhetetlen egy „arany középút” követése, azaz a szenzorok aktívan tartása az emelkedett ROS szinttel, ugyanakkor a szignalizáció megtörténtét követően még idejében csökkenteni kell a toxikussá vált ROS koncentrációt.
A protein-sérülés szenzorok egyaránt érzékenyek a fehérje oxidatív vagy strukturális sérüléseire (unfolding). A kategória két legismertebb molekuláris chaperonja, az FtsH és a Lon fehérjék.
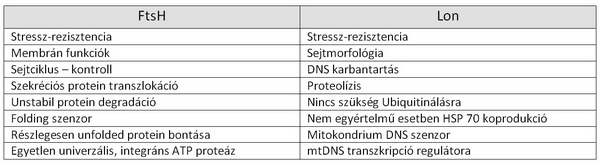
4. ábra. A protein-sérülés szenzorok (FtsH és Lon) funkcióinak összehasonlítása.
Stresszor specificitásuk alacsony, azaz bármilyen típusú stresszben aktivizálódnak. Elsősorban mitokondriumban és kloroplasztiszban találhatók, de homológjaik révén (citoplazmatikus, nukleáris lokalizáció – 26S proteaszóma részeként) direkt vagy indirekt módon minden organellumban aktívak.