A CSR nem csupán anyagcsere szintű változásokat generál a sejtben, annak minden molekuláris velejárójával, hanem befolyásolni képes a sejtorganellumok közti szignalizációt is. Ebben a fejezetben a sejt Ca2+ raktárainak (ER és a mitokondrium) kommunikációját elemezzük. Mind az ER, mind a mitokondrium dinamikus organellumnak tekinthető. Citoszkeletonnal kapcsolt mozgásuk a sejtben régóta ismert és intenzíven kutatott területe a sejtbiológiának. A mitokondrium állandó morfológiai átalakulásokon megy keresztül. A sejt energiaigényének megfelelően diszkrét (szoliter, egyedülálló) vagy hálózatba kapcsolódó mitokondriumokkal találkozhatunk. Transzmissziós elektron mikroszkópos vizsgálatok régóta jeleztek valamiféle kapcsolatot a két dinamikus sejtalkotó közt, azonban kezdetben ezt mellékterméknek, hibának vélték. Később a ko-szedimentációs vizsgálatok és az élő – sejt feltöltések (green fluoreszcens protein, GFP) igazolták az inter – organelláris kapcsolatot. Azóta tudjuk, hogy mindkét organellum membránjának speciális fehérjéi részt vesznek a dokkolásban, kialakítva ezzel egy komplex, extra- és intracelluláris változásokra gyorsan reagálni képes rendszert. Az összekötő elemek (tether fehérjék) általában 6 tagú csoportokban azonosíthatók. A mitokondrium külső membránjának (OMM) és az ER zsákok kapcsolása a feladatuk. Változatos hosszal rendelkeznek (SER esetén: 9-16 nm, míg DER-nél minimum 20 nm). Ez a heterogenitás az inter – organelláris távolság gyors változtatását szolgálja. Az 5. ábrán egy mitokondrium és 3 ER zsák kapcsolódását láthatjuk (tether fehérjék nyílheggyel jelezve).
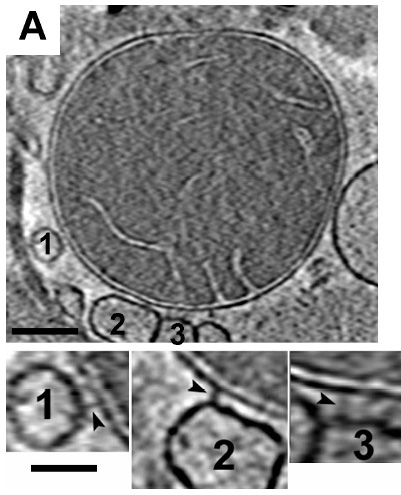
5. ábra. A mitokondrium és az ER kapcsolódásának elektronmikroszkópos bizonyítéka. Csordas, G, C. Renken, et al. (2006). "Structural and functional features and significance of the physical linkage between ER and mitochondria." J Cell Biol 174 (7): 915-21.
A két organellum összekapcsolásában a mitokondrium – dinamika fehérjéi is részt vesznek (mitochondrial shaping proteins). Ezek a dinamin related protein (DRP), a mitofusin (MFN), a fissziós portein (hFIS) és az optikus atrófia protein (OPA1). Pro- (BIK, BAX, BAK) és anti-apoptótikus proteinek (Bcl-2, Bcl-XL) is részt vesznek a kapcsolat szabályozásában. A kapcsolódó felszínek nagysága fontos szempont a kommunikációban. Az interakció speciális pontokon, specifikus molekulák kapcsolódása révén jön létre. A legismertebb kapcsolódási pont, az ún. Ca2+ alagút. Ennek a molekuláris kapcsolóhídnak a pilléreit az ER-rezidens Inozitol-trifoszfát (IP3) receptor és a mitokondrium-rezidens feszültségfüggő anion csatorna (VDAC) alkotja. Őket köti össze a Grp75 chaperon. A két organellum direkt membrán kapcsolatát a multifunkcionális phosphoric acid cluster sorting protein (PACS-2) biztosítja. A kapcsolat egyéb résztvevőit és a Ca2+ alagutat a 6. ábrán azonosíthatjuk.
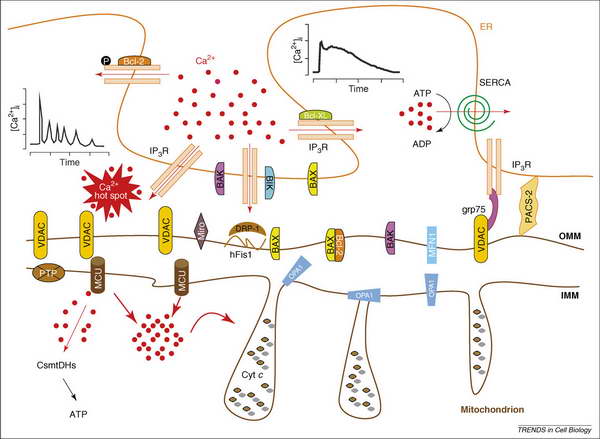
6. ábra. Az ER – mitokondrium közti kapcsolat sematikus ábrázolása. Rövidítések: CsmtDHs, Ca2+ sensitive mitochondrial dehydrogenases; Cyt c, cytochrome c; IMM, inner mitochondrial membrane; IP3R, inositol 1,4,5-trisphosphate receptor; OMM, outer mitochondrial membrane; MCU, mitochondrial Ca2+ uniporter; PTP, permeability transition pore; SERCA, sarcoplasmic-endoplasmic reticulum Ca2+ ATPase; VDAC, voltage dependent anion channel. Pizzo, P. and T. Pozzan (2007). "Mitochondria-endoplasmic reticulum choreography: structure and signaling dynamics." Trends Cell Biol 17 (10): 511-7.
A kialakult kapcsolatokat limitált proteolízissel (tripszin) bontani lehet, míg mesterséges (5 nm-nél rövidebb) linker elemekkel szorosabbra fűzhető a két organellum. A 7. ábra egy ilyen mesterséges kapcsoló elemmel végzet kísérlet eredményeit foglalja össze.

7. ábra. Az ER – mitokondrium kapcsolat erősítése kapcsoló – fehérjék alkalmazásával. Csordas, G, C. Renken, et al. (2006). "Structural and functional features and significance of the physical linkage between ER and mitochondria." J Cell Biol 174 (7): 915-21.
Az „A” képen az OMM-et egy mitokondriális target szekvenciával (mAKAP1(34-63) szerelt jelző fehérjével (monomer red fluroszcens protein – mRFP) vizualizálták. A két organellum membránjának szorosabb kapcsolását egy 5 nm-nél rövidebb konstrukcióval végezték el. Ez a konstrukciós tether fehérje egy mRFP két terminálisára kapcsolt mitokondriális és ER target szekvenciát (yUBC6) tartalmazott. Az ábrán a piros nyilak az ER és a mitokondrium kapcsolatát jelképezik. Ahogy a kinagyított ábrarészleten és a táblázatból is kitűnik, a kapcsoló molekula bevezetésével drasztikusan csökkent a két organellum közti távolság, ugyanakkor a két organellum közös felszínének mérete jelentősen megnőtt. Amennyiben a sejteket apoptótikus stressznek tesszük ki (szérum megvonás illetve tunicamycin toxin), rövidül a két organellum közti távolság. A tunicamycin egy streptomyces toxin, amely G1 fázisban tartja a sejtet és kísérletesen sejt stressz vizsgálatára használják. Fontos megjegyeznünk, hogy a távolság csökkenése még intakt sejtben kezdődik meg és az apoptótikus folyamatok indukciójának egyik kezdeti lépése.
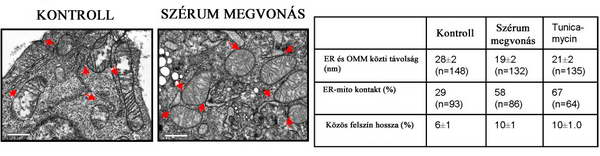
8. ábra. Az ER – mitokondrium kapcsolat és a sejt túlélésének kapcsolata. Csordas, G, C. Renken, et al. (2006). "Structural and functional features and significance of the physical linkage between ER and mitochondria." J Cell Biol 174 (7): 915-21.
A két sejt organellum egymáshoz viszonyított távolsága kihatással van a funkciójukra is. A mitokondrium és ER lokalizációjának 3 lehetséges típusát szemlélteti a 9. ábra.
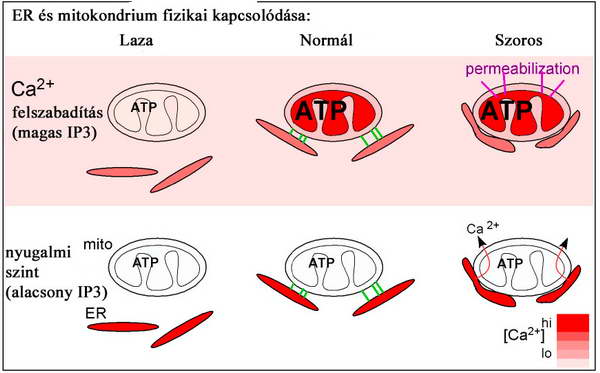
9. ábra. Az ER és a mitokondrium közti távolság és a funkció kapcsolata. Csordas, G, C. Renken, et al. (2006). "Structural and functional features and significance of the physical linkage between ER and mitochondria." J Cell Biol 174 (7): 915-21.
Fiziológiás állapotban a távolság optimális a Ca2+ szignalizáció számára. A két organellum funkciója arányos a sejt aktuális aktivitási szintjével (mitokondrium: ATP termelés, ER: Ca2+ szint). A két sejtalkotó szétválásával, a mitokondrium számár felhasználható Ca2+ koncentráció csökkenésével sérül a mitokondrium anyagcsere, amely következetes oxidatív foszforilációs zavarokhoz, ATP szint csökkenéshez és akár apoptózishoz vezet. Stressz hatására a távolság csökken a két organellum közt és a mitokondrium folyamatosan Ca2+ ionokat vesz fel, ezzel ún. túltöltődés következik be (Ca2+ overload). A nyugalmi állapotban is folyamatosan szenzitizált (érzékenyített) mitokondriumban bekövetkezik a mitokondriális membrán permabilizáció (MMP), amely apoptózist indukál. Meg kell említenünk, hogy a sejt legdinamikusabb sejtalkotója révén, a mitokondrium migrációja is zavart szenved, ha az ER-rel a normálisnál nagyobb felületen rögzül. Ezáltal az ATP elosztás és a Ca2+ puffer kapacitás is sérül, amely a nagy kompartmentekkel rendelkező különösen aktív sejtekben veszélyes, mint a neuron.