A fehérjék elsődleges aminosav-sorrendjéből a molekuláris chaperonok és foldáz enzimek egy háromdimenziós szerkezetet készítenek. Ez a hajtogatás vagy folding folyamata, amely kulcs eleme az ER-stressznek és ebből kifolyólag számos patológiás állapotnak is. A foldázok egyes kémiai rekciók katalíziséért felelnek, megszabva ezzel a folding sebességét is (rate - limiting faktorok). A két leggyakoribb ilyen reakció a cysteinek közti kovalens kötés kialakítása (PDI) illetve a cisz-transz izomer váltás (PPI). Az ER chaperonjait az 1. ábra foglalja össze.

1. ábra Az ER molekuláris chaperonjai. Hebert, D. N. and M. Molinari (2007). "In and out of the ER: protein folding, quality control, degradation, and related human diseases." Physiol Rev 87(4): 1377-408.
A folding folyamatosan, két fázisban zajlik. A fehérje transzlációja közben (ún. kotranszlációs folding) már megfigyelhetők kisebb módosítások az ER lumenébe transzlokálódó polipeptid láncon (pl. ubiquitináció, hibás szintézis terminációja). Ezt követi a jól ismert poszttranszlációs folding, amely már az ER lumenében található nascens (transzlálódott, de még nem módosított) polipeptidlánc térszerkezetének megváltoztatását jelenti.
Amennyiben az ER-loading meghaladja a sejt szekréciós tevékenységét, vagy az ER kapacitását, kialakul az ER-stressz. Tekintettel a számos következményre (Ca2+ homeosztázis felborulása, folding apparátus sérülése, apoptózis), a sejtnek alapvető érdeke ennek az állapotnak a mihamarabbi megszüntetése. Azon sejtjeink, amelyeknél funkciójuk révén valószínűsíthetően gyakran fordulhat elő ER-stressz, alkalmazkodtak ennek prevenciójához. Ezek a sejtek elsősorban az ún. professzionális szekréciós sejtek, amelyek életciklusuk folyamán állandóan, hatalmas mennyiségben állítanak elő környezetük számára fehérjéket (pl. plazmasejt). Ezek a sejtek képesek akár strukturális változásokat is generálni a sejtorganellumaikban, hogy csökkentsék az ER-stressz valószínűségét. A legjellemzőbb ilyen strukturális változtatás a plazmasejtek esetében figyelhető meg, mint az ER lumenének drasztikus megnövelése, amely ezen sejtek TEM differenciál diagnózisává vált. A sejtanyagcsere termékek felszaporodása ROS képződést és a fehérjeszintézis emelkedését vonja maga után. Ezek a változások azonban kiváltják az UPR-t és a sejtekben inflammatorikus folyamatokat indítanak el. Az UPR és inflammatórikus folyamatok egymást erősítik, sejttípustól függően különböző patológiás állapotokhoz vezetnek.
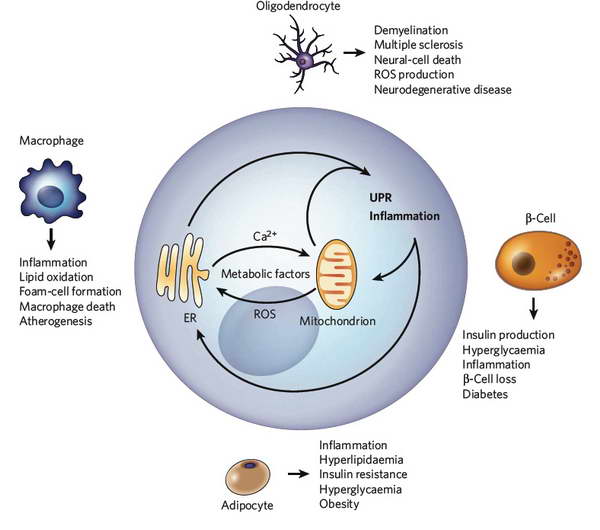
2. ábra ER-stressz specializált sejtekben. Zhang, K. and R. J. Kaufman (2008). "From endoplasmic-reticulum stress to the inflammatory response." Nature 454(7203): 455-62.
Fejezetünkben a glikoproteinek példáján keresztül tekintjük át a chaperonok és a folding apparátus működését. Ezen fehérjék az ER-be jutás során glükóz oldalláncokat kapnak, hogy a specifikus enzimek felismerhessék őket a további reakciók során. A három legismertebb chaperon (GRP78/BIP, GRP94, CNX/CRT) jellemzését a 3. ábrán olvashatják.

3. ábra Az UPR kulcsenzimeinek összefoglalása.
Az ún. lektin chaperonok készítik fel az ER-be jutott glikoproteineket a foldingra, megfelelő pozícióban elhelyezett szénhidrát oldalláncok felhelyezésével.

4. ábra Glikoproteinek felkészítése ER foldingra. Hebert, D. N. and M. Molinari (2007). "In and out of the ER: protein folding, quality control, degradation, and related human diseases." Physiol Rev 87(4): 1377-408.
A nascens polipeptid lánc aszparagin – szerin/treonin szekvenciájához kovalensen kapcsolódik egy kilenc tagból álló mannóz prekurzor. A, B, C, D jelzik azokat a mannózókat, amelyeket a glikozil-hidroláz család tagjai távolítanak el. A legdisztálisabb pozícióban a glükóz oldalláncok találhatók, amelyek a glikozidáz család szubsztrátjai. A 1. glükózt a glikozidáz I., míg a 2. és 3. glükózt a glikozidáz II. távolítja el, alkalmassá téve ezzel a proteint a folding ciklusba való belépésre. A konfigurációjában vagy számában a normálistól eltérő szénhidrát oldallánc gátolja a fehérje belépését a folding ciklusba és ez funkcióvesztést, degradációt von maga után. A folding ciklus egy meglehetősen bonyolult, sok ponton szabályozott folyamat, amely a nascens polipeptidlánc ER-lumenbe történő permeabilizációjával veszi kezdetét. A fehérje állapotát folyamatos ellenőrzés alatt tartják a különböző chaperonok, szükség esetén újrahajtogatást (refolding) vagy a terminálisan hibás (misfolding) fehérje esetén degradációt (ERAD) indukálnak. Az 5. ábra bemutatja egy glikoporetin sorsát az ER folding apparátusában.
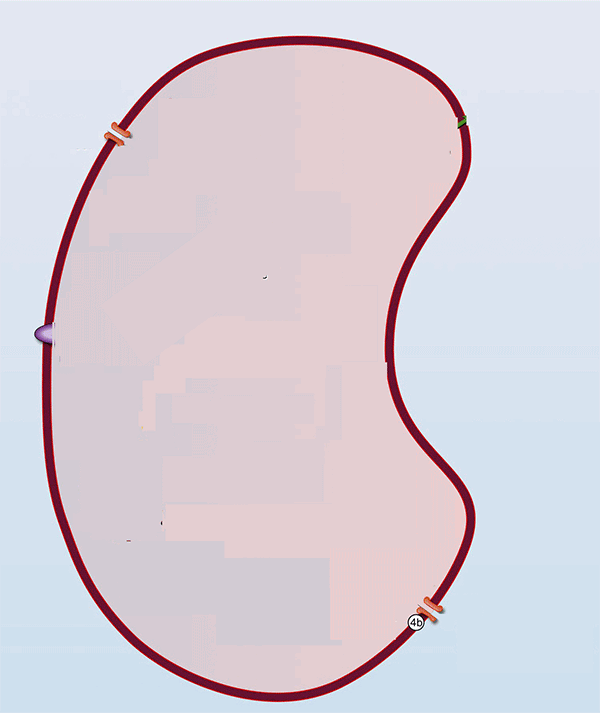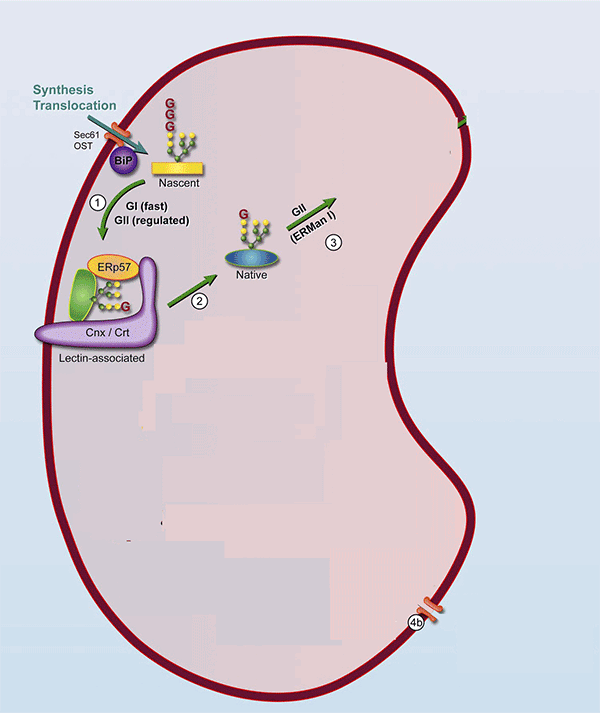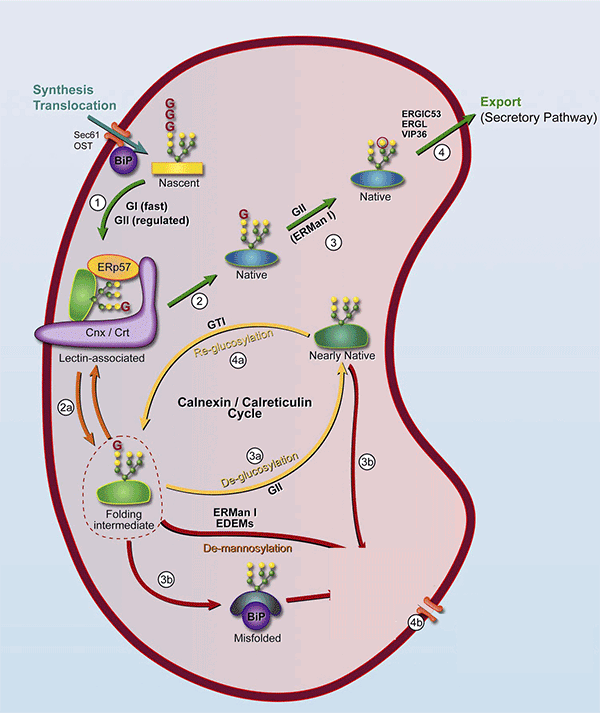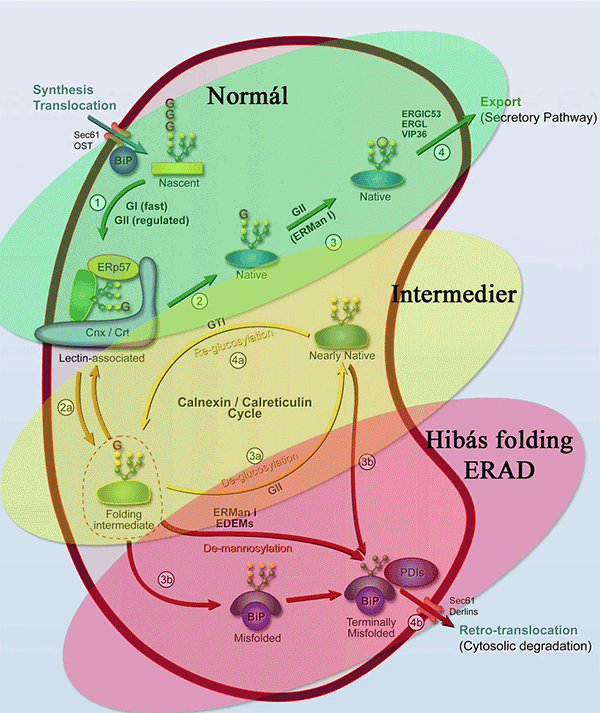
5. ábra Glikoproteinek sorsa az ER-ben. Hebert, D. N. and M. Molinari (2007). "In and out of the ER: protein folding, quality control, degradation, and related human diseases." Physiol Rev 87(4): 1377-408.
Az animáció egyes lépéseit tanulmányozva megfigyelhetjük, hogy a glikoprotein a bekerülést követően rögtön megkapja a szénhidrát oldalláncait, amelyet a chaperonok felismernek és feldolgozzák a fehérjét. Normál esetben (1-4 lépés) a CNX/CRT lektinek munkája révén néhány módosító lépés után a fehérje elhagyhatja az ER lumenét és a szekretoros útvonal következő állomására léphet (Golgi apparátus). Amennyiben az ellenőrzőpontokon hibát fedeznek fel, a fehérjét újrahajtogatásra ítélik a chaperonok (refolding ciklus, intermedier szakasz, 2a-4a lépés). Javíthatatlan hiba esetén (terminális misfolding) a fehérjét az ERAD enzimei kötik meg és a szénhidrátláncokat lehasítják a felszínéről (3b-4b lépések), ezzel előkészítik a retro-transzlokációt, amelynek során a fehérje elhagyja az ER lumenét és a citoplazmatikus degradáció fázisába lép.
A fentiekben a glikoporteinek poszttranszlációs foldingját tekintettük át, azonban egy átlag emlős fehérje transzlációja 2 percig tart és ez az idő nem elegendő a tökéletes foldinghoz. Ezért már a transzláció alatt meg kell kezdeni az elkészült polipeptid szakasz hajtogatását. Ezt nevezzük kotranszlációs-, vagy (tekintettel a polipeptid lánc riboszómáról ER lumenbe történő transzlokációjára) kotranszlokációs foldingnak .

6. ábra Kotranszlációs folding komplex felépítése. Hebert, D. N. and M. Molinari (2007). "In and out of the ER: protein folding, quality control, degradation, and related human diseases." Physiol Rev 87(4): 1377-408.
A szintézis során minimalizálni kell a keletkező intermedierek számát. Ezzel gyorsítható a folyamat és növelhető a pontosság is. A készülő polipeptidlánc ugyanis képes saját magával vagy a környezetében található másik lánccal hibridizálódni, ami természetesen megakadályozza a további szintézist. A lánc karboxi terminálisa a riboszómán kötött, ez csökkenti a spontán intermedier képződést és elősegíti az ún. vektoriális irányban haladó (NH2 – COOH) foldingot. A kotranszlációs folding biztosítja a fogadó környezet optimalizálását a sérülékeny nascens polipeptidlánc számára. Az első chaperon, amely a fehérjéhez köt a BIP, amely felfogható egy ún. unfolding szenzornak is, mert ez a fehérje érzékeli a polipeptid lánc folding állapotát és önmagában képes indukálni az UPR-t. A kotranszlációs folding komplex a polipeptidlánchoz sorban hozzákapcsolódó enzimeket jelenti. Ez a komplex egymástól is szeparálja a polipeptidláncokat. A komplex egyes tagjainál eltöltött időt a fehérje szekvenciája szabályozza, az „érettebb” konformációk az ER lumen mélyebb régióiban lokalizáltak.
Az ERAD folyamata során a javításra alkalmatlan (misfolded) fehérjék deglikozilációja, citoplazmába történő retro-transzlokációja, ubiquitinálása, aminósav elemekre történő degradációja (26S proteaszóma), majd ezek reciklizációja zajlik. ER-stresszben, az ER overloading elkerülése érdekében előfordulhat a fehérjék transzláció – termináció előtti ubiquitinálása. Hibás ERAD aberráns fehérjék akkumulációjához vezet (ER-stressz, apoptózis, klinikai állapotok). Kulcsfontosságú a különböző állapotú (nascens, misfolded, unfolded) fehérjék tökéletes felismerése és elkülönítése. Az ERAD alapvetően a glikozilhidrolázok 3 családjának irányítása alatt áll.
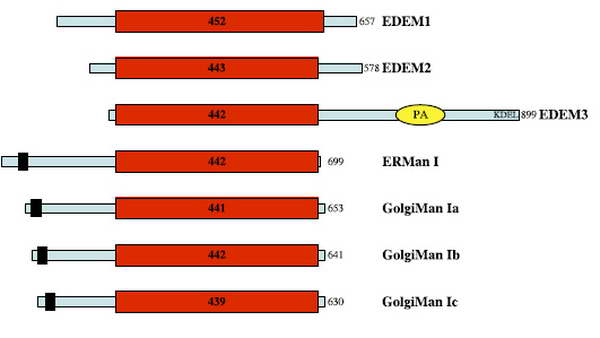
7. ábra ER-asszociált degradáció enzimei. Hebert, D. N. and M. Molinari (2007). "In and out of the ER: protein folding, quality control, degradation, and related human diseases." Physiol Rev 87(4): 1377-408.
Az EDEM-ek az Ire1/Xbp1 ER-stressz útvonal target enzimei. Ezen enzimek aktiválásának célja az ERAD kapacitásának növelése UPR esetén. Amennyiben normál fehérje esetén a folding ciklus túllépi a 90 percet, az ERAD automatikusan aktiválódik. Ennek szabályozását az ERManI végzi.