Az apoptotikus sejthalált külső és belső tényezők egyaránt kiválthatják, így az irodalmi (angol) szóhasználat alapján extrinsic és intrinsic útvonalat különíthetünk el.
A külső faktorok a sejthalált elszenvedő sejt környezetéből származnak, s lehetnek például vírusok vagy DNS károsító, mutagén hatások (ilyen a sugárzás), illetve származhatnak egy másik sejtből is (9. ábra). Vírus fertőzés esetében olyan MHC-komplexek jelennek meg a sejt felszínén, amelyek virális antigéneket is tartalmaznak, s amelyeket citotoxikus T- vagy természetes ölő sejtek ismernek fel. Az „öngyilkosságra kényszerülő” sejt felszínén lévő halál receptorok (l. következő fejezet) akkor aktiválódnak, amikor az ölő sejt felszínén lévő megfelelő ligandumok hozzájuk kötődnek (10. ábra). A külső hatásra beinduló „szignalizáció” a célsejt pusztulásához vezet.
A belső faktorok a sejtben keletkeznek, általánosan megfogalmazva, valamilyen stressz hatására. Ahogy látni fogjuk, mindkét útvonal érinti a citoplazmát és azokat a mitokondriumokat is, amelyek károsodása kulcsszerepet kap a sejthalál belső tényezők általi kiváltásában (9. ábra).

9. ábra. Az apoptotikus sejthalált kiváltó néhány külső és belső hatás (az utóbbiak sárga keretben). Látható, hogy a mitokondriumok mindkét útvonalban érintettek
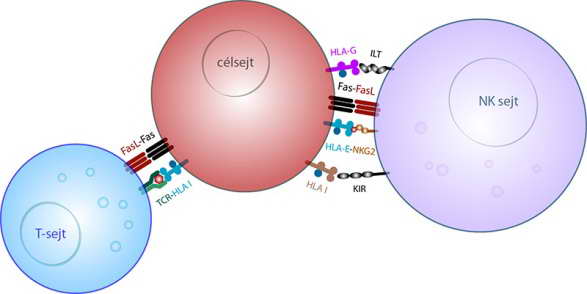
10. ábra. Az „öngyilkosságra kényszerülő” célsejt immunsejtek általi felismerésében szerepet játszó néhány receptor-ligandum komplex (NK: természetes ölő sejt). A Fas és Fas ligandum szerepéről l. a szöveget
Az aktív sejthalál apoptotikus formájának molekuláris mechanizmusa kivétel nélkül minden esetben bizonyos proteolitikus enzimek működésének beindulásával és/vagy aktivitásának fokozódásával kezdődik. A folyamat teljes kivitelezésében, sőt, a „sejthullák” végső eltakarításában is dominálnak a sejten belüli fehérjebontó enzimek.
A kaszpázok olyan, ciszteinben gazdag proteázok (cisztein proteázok), amelyek egy 4 aminosavból álló úgynevezett konszenzus szekvencia mellett hasítják el a peptidkötést. Ennek az aminosav-motívumnak az utolsó tagja minden esetben egy aszparaginsav (11. ábra). A kaszpázok ezen tulajdonsága eredményezi azt, hogy szubsztrátumaikat rendkívül pontosan, csak meghatározott helyeken és csak részlegesen bontják (limitált proteolízis).
A fenti tulajdonságokkal rendelkező enzimeket a korábbi szakirodalomban még ICE (Interleukin Converting Enzyme) néven találjuk meg. Az elmúlt 20 év kutatásai során azonban több mint 10 tagra bővült a hasonló szerkezetű és aktivitású, bár különböző névvel illetett enzimek száma. Ezért logikus és szükséges lépés volt a közös tulajdonságon alapuló, egységes nevezéktan bevezetése és az enzimek egy közös családba való besorolása (caspases: cisteinil aspartate-specific proteases). Itt az egyes „családtagokat” számozással különböztetjük meg egymástól. Az emlős kaszpázok családja jelenleg 13 tagból áll (12. ábra).
Valamennyi kaszpáz tulajdonsága, hogy szintézise során inaktív, proenzim (prokaszpáz) formában jelenik meg. Az aktiváláshoz az N-terminálison lévő úgynevezett prodomén lehasítása szükséges. Az ezután megmaradó, az enzimatikus működéshez szükséges fehérje minden kaszpáz esetében két részből áll. Ezek közül a nagyobb (large, l) egy úgynevezett p20, a rövidebb (small, s) egy p10 domént képez (11. ábra). A kaszpázok aktiválásához szükséges szerkezeti átalakítások érdekében tehát olyan hasításokra van szükség, amelyeket egy másik, ugyanolyan vagy más számmal jelzett kaszpáz képes végrehajtani.
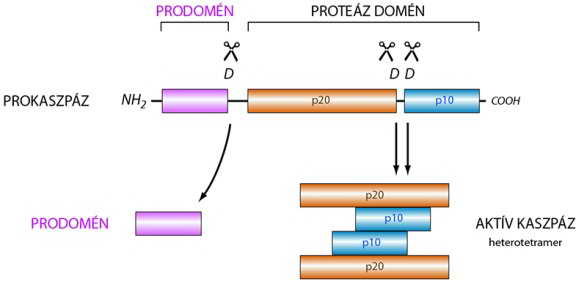
11. ábra. A zimogén prokaszpázok kaszpáz-specifikus hasítási helyei (D: aszparagin sav)
Az egy családba tartozó kaszpázokat funkciójuk és szerkezetük alapján is alcsaládokba sorolhatjuk. Az egyes családtagokat számozással különítjük el egymástól. 13 féle humán kaszpázt különböztetünk meg, amelyek nevei kaszpáz-1–kaszpáz-14. Arról a molekuláról, amelyet korábban kaszpáz-13-ként tartottak számon kiderült, hogy nem létezik (kísérlet következtében keletkezett műtermék)
A prodomén lehet rövid vagy hosszú. A rövid prodoménű enzimek a kaszpáz-3, -6, -7 és -14 (12. ábra). Az utóbbi (kaszpáz-14) kivételével valamennyien az apoptózis „végjátékában” szerepelnek, mint végrehajtó, effektor, vagy exekutor[1] kaszpázok (III. típus). Prodoménjük 30-nál kevesebb aminosavból áll, s azon kívül, hogy biztosítja inaktív állapotukat, semmilyen más funkcióval nem rendelkezik.
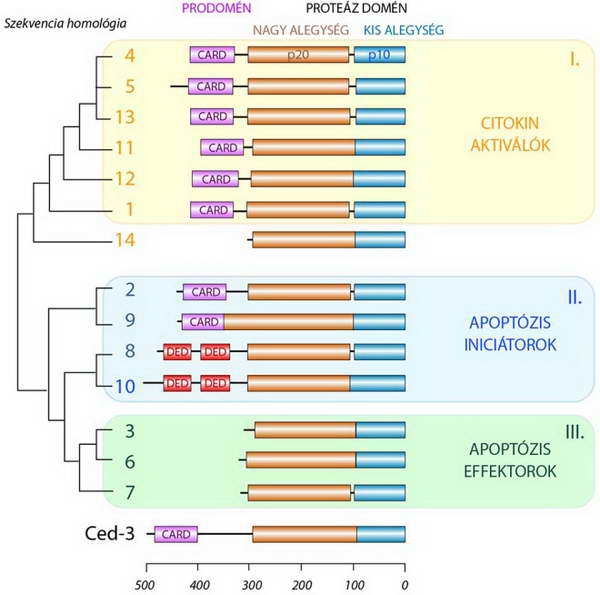
12. ábra. Az emlős kaszpázok szerkezeti felépítése és az ez alapján megállapítható csoportjai. Alul a Ced-3, a C. elegans kaszpáz homológjának a szerkezete látható. (CARD: caspase activating recruiting domain; DED: death effector domain, Ced-3: cell death abnormality-3)
A hosszú prodoménű kaszpázok esetében a pro-régió összetettebb és a sejt további élete szempontjából sorsdöntő funkcióval is bír(hat).
Ide tartoznak az aktív sejthalál apoptotikus formájának beindításában kulcsszerepű úgynevezett iniciátor kaszpázok (kaszpáz-2, -8, -9, -10), amelyeknek olyan prodoménjei vannak, amelyekben fehérje-interakciós mikrodomének találhatók. Ez utóbbiak alapján körükben két alcsoportot különítünk el. A kaszpáz-8 és -10 szerkezetében két-két egymást követő (tandem) DED (death effector domain) régió, míg a kaszpáz-9 és -2 molekulában egy-egy aktiváló és toborzó, úgynevezett CARD (caspase activating recruiting domain) régió található (12. ábra).
A DED és CARD mikrodomének révén az ezekkel rendelkező kaszpázok hasonló doménekkel rendelkező molekulákhoz tudnak kapcsolódni, ami alapvetően meghatározza azt, hogy a sejtben milyen molekuláris komplexum részeként és hogyan aktiválódnak (l. A kaszpázok aktivációja c. fejezetet).
A kaszpázok három csoportba sorolhatók aszerint, hogy milyen folyamatok aktiválásában vesznek részt (12. és 13. ábra). Az I. csoportba azok tartoznak, amelyek citokineket aktiválnak, így gyulladásos folyamatok előidézésében vesznek részt. CARD prodoménnel rendelkeznek.
A II. csoportba az apoptózis beindításában szerepet játszó, iniciátor kaszpázok tartoznak. Mind hosszú prodoménnel rendelkeznek, amelyben tandem DED vagy egy CARD mikrodomén található.
A III. csoportot az apoptózis végrehajtásában szerepet kapó effektor kaszpázok képezik. Kivétel nélkül rövid prodoménű kaszpázok.
Mai ismereteink szerint egyetlen kaszpáz nem sorolható be a fenti csoportokba. Ez a kaszpáz-14, amely rövid prodoménű. Korábban citokin-aktiválónak tartották, de ma már bizonyos, hogy egy harmadik aktív sejthalál típusban, a keratinizációban játszik szerepet (l. 1. ábra). Csak az epidermiszben expresszálódik, s egy eddig még azonosítatlan proteáz aktiválja. A fenti alapokon képzett csoportokat a 13. ábra mutatja be.
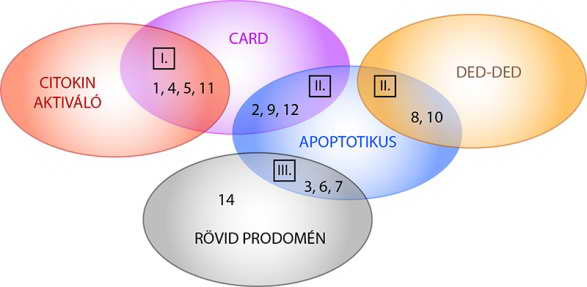
13. ábra. A kaszpázok besorolása a szerkezeti és funkcionális alapon képzett csoportokba: a funkcionális csoportokat római számok jelzik
A kaszpázok szerepe az eukarióta sejtek működésében sokkal kiterjedtebb, mint azt korábban gondoltuk. Az irreverzibilis apoptózis mellett számos sejtszintű átrendeződési folyamatban (remodeling) nélkülözhetetlenek. Ilyen például a vörösvértestek képződése (erythropoesis), a makrofágok differenciációja, az elszarusodás (l. kaszpáz-14), a vázizomzat differenciálódása, illetve a spermatidák individualizálódása (a közöttük lévő citoplazma hidak felszakadása). Természetesen nem feledkezhetünk meg a citokinek érésében, az örökletes (nem specifikus) immunrendszerben (innate immune system) betöltött szerepükről sem.
Nem meglepő tehát, hogy mai ismereteink szerint az emberi fehérjekészlet (proteom) mintegy 1000 féle fehérjéről tudjuk már azt, hogy limitált hasításukat kaszpázok végzik.
Amint azt már korábban említettük, a prokaszpázok aktiválása limitált proteolízissel, azaz a prodomének lehasításával és a nagy (p20) és kis (p10) alegységek közötti, kaszpáz specifikus konszenzus szekvencia melletti peptidkötések elbontásával történik (11. ábra). Mivel a hasító-helyet kijelölő (konszenzus) szekvencia egyben kaszpáz-specifikus is, ennek alapján a kaszpázokra jellemző az autokatalízis (amikor ugyanazon típus molekulái kölcsönösen hasítják egymást). Többféle kaszpázról lévén szó, ez egyben azt is lehetővé teszi, hogy a kaszpázok több tagból álló reakció sorokba rendeződjenek (úgynevezett kaszpáz-kaszkádok). Nyilvánvaló, hogy a sor elején olyan molekulák állnak, amelyek autokatalízissel aktiválódnak – ezek lesznek az iniciátor kaszpázok, míg a kaszkád sort a végrehajtó kaszpázok zárják (14. ábra).
A 14. ábrán egyértelműen látható, hogy az aktív enzimet két-két p20 és p10 domén alkotja, ami csak két prokaszpáz molekulából származhat. Az aktivációnak tehát van még egy feltétele, s ez a proenzimek összegyűjtése, toborzása (recruiting).
Az iniciátor kaszpázok esetében az aktiváció nagy, többkomponensű molekuláris komplexumokban történik (DISC vagy apoptoszóma, l. később), míg az effektor kaszpázokat vagy aktív iniciátor kaszpázok, vagy a citotoxikus T-sejtek által a célsejtbe juttatott granzyme-B enzimek, vagy Ca2+-aktivált proteolitikus enzimek, az úgynevezett kalpainok aktiválják.
Az iniciátor kaszpázok tandem DED doménnel rendelkező proenzimei (prokaszpáz-8 és -10) közvetlenül a célsejt membránjához kötődő sejthalál indukáló molekuláris komplexumai (DISC: death inducing signaling complex) révén aktiválódnak (14. és 15. ábra). A DISC fő komponensei a halál receptorok (DR, death receptors), amelyek valamennyien a tumor nekrózis faktor receptor (TNF-R) szupercsalád tagjai. Közös szerkezeti jellemzőjük, hogy a sejtközötti tér felé néző ligandum-kötő régiójuk mellett van egy hidrofób transzmembrán doménjük, valamint a C-terminálison egy fehérje-interakciós, úgynevezett halál doménjük (DD: death domain). Ilyen receptorok többek között még a Fas és a TRAIL-receptor (TRAIL: TNF-alpha-related-apoptosis-inducing ligand) is. Ma már a sejthalál receptorok esetében is törekszenek a nevezéktan egységesítésére, és számozással történő megkülönböztetésükre. Valamennyi sejthalál receptorra a DR rövidítést használják (DR1: TNF-R1, DR2: Fas/Apo1, DR3: Apo2, DR4: TRAIL-R1, DR5: TRAIL-R2).
A receptoroktól kiinduló szignalizációs útvonalat, azaz a kaszpázokból álló kaszkád sor aktivációját és szerveződését a Fas(-receptor)–iniciátor prokaszpáz-8 példájával mutatjuk be.
Az iniciátor kaszpázok, így a prokaszpáz-8, nem képesek közvetlenül a halál receptorokhoz kapcsolódni. A szignalizációhoz a receptor trimerizációja szükséges, amit a ligandum kötése vált ki. Miután a Fas-receptor oligomerizációját a Fas-ligandum kiváltotta, a receptor konformáció változáson megy át. Ez lehetővé teszi olyan, a citoplazmában szabadon jelen lévő adaptor molekulák receptorhoz kötését, amelyeknek kétféle fehérje interakciós doménje van. Ilyen adaptor fehérje a FADD (Fas associated death domain), amely a halál doménjével (DD) a halál receptorral (Fas-), míg a halál effektor doménjével (DED) a prokaszpáz-8 DED régiójával képes kölcsönhatásba lépni (14. és 15. ábra). Ahogy az ábrán látható, az adaptor fehérjék több prokaszpáz-8 molekulát gyűjtenek és rendeznek maguk mellé, amelyek így megfelelő közelségbe kerülnek egymáshoz ahhoz, hogy egymást aktiválják. Két iniciátor prokaszpáz-8 molekulából lesz egy aktív, heterodimer (tetramer) szerkezetű aktív enzim. A DISC-ben megtörténik a két proenzim molekula belső, konformációs átrendeződése és autokatalitikus aktiválódása. A DISC-ből kiváló aktív kaszpáz-8 a továbbiakban effektor prokaszpáz (pl. prokaszpáz-3) proteolitikus aktivációjára képes (14. és 15. ábra).
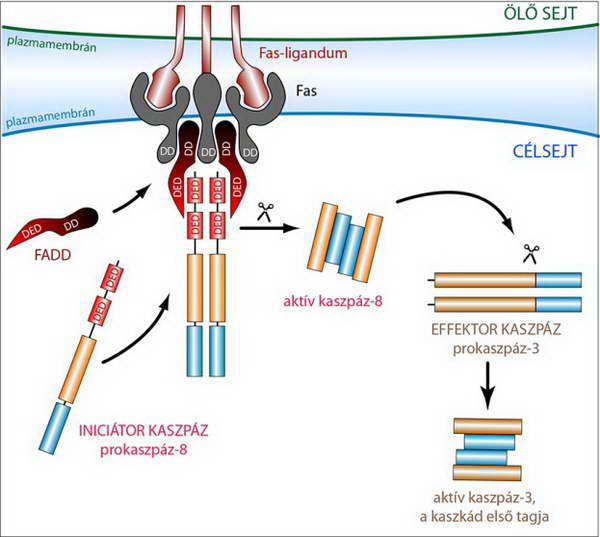
14. ábra A prokaszpáz-8 Fas(-receptor) általi aktiválása, amelyben a FADD adaptor fehérje vesz részt. A trimerizálódott Fas magához gyűjti a FADD adaptor fehérjéket, azok pedig a prokaszpáz-8 molekulákat. Az így összeállt DISC-ből aktív kaszpáz-8 molekulák szabadulnak fel, amelyek effektor kaszpázt aktiválnak (a rövidítések jelentését l. a szövegben)
A külső sejthalál stimulusok által beindított kaszpáz-kaszkád felpörgése, valamint az aktív effektor kaszpázok koncentrációjának ugrásszerű megemelkedése a sejt normális működéséhez nélkülözhetetlen szerkezeti és szabályozó fehérjék tömeges lebontásához vezet. Ennek következményeként a citoplazmatikus és a sejtmagi vázrendszer dezorganizálódik, az intracelluláris transzport folyamatok súlyosan károsodnak, alapvető sejtélettani folyamatok leállnak.
Az enzimek egy részének proteolitikus aktiválása mellett az aktív effektor kaszpázok (pl. a kaszpáz-3) inaktív enzimek inhibítor régiójának lehasításával olyan enzimeket aktiválnak, amelyek nukleáz aktivitással rendelkeznek, s kiemelt szerepet játszanak az apoptotikus sejt DNS állományának internukleoszómális (oligonukleoszómális) fragmentálásában. Ilyen például az ICAD (inhibitor of CAD), amely a CAD (caspase activated DNA-se) enzimhez kötődve inaktiv állapotban tartja azt. Kaszpáz általi elhasítását követően azonban leválik a CAD molekuláról, így az aktív DNS hasító enzim bejuthat a magba (15. ábra).
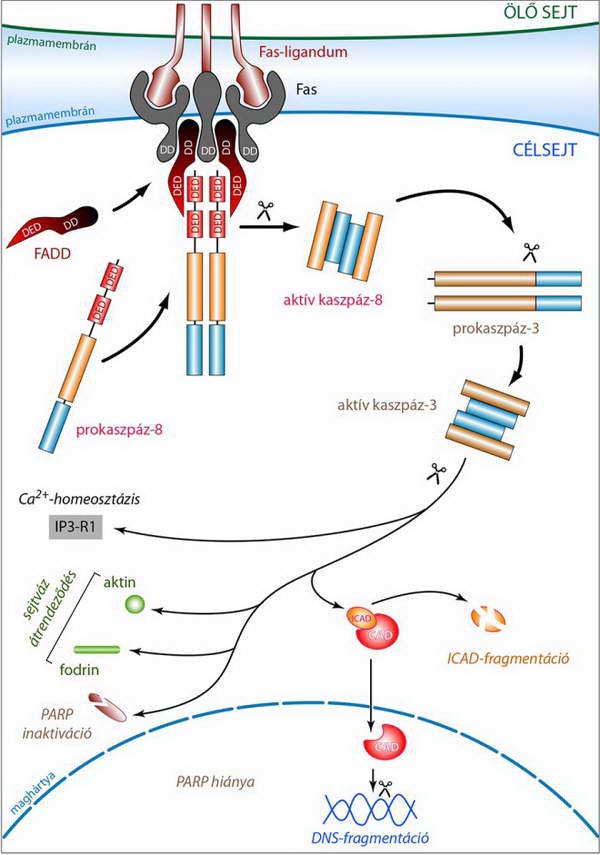
15. ábra A kaszpáz-8 által aktivált útvonal hatásai: a DISC-ből felszabaduló iniciátor kaszpáz-8 effektor prokaszpáz-3 molekulákat aktivál. Ezek számos olyan fehérje részleges proteolízisét végzik, amelyek funkciójának kiesése a sejtváz és a kromatin állomány feldarabolódásához, széteséséhez vezet (PARP: polyADP-ribose polymerase, a sérült DNS szerkezetének helyreállításában játszik szerepet)
A CAD a DNS szálból kivágja az internukleoszómális szakaszokat, ami előbb-utóbb a kromatin állomány nukleoszomális méretű feldarabolódásához vezet (16. ábra). (Az ily módon történő fragmentáció során csak meghatározott méretű (kb. 180 nukleotid és annak többszörösei) DNS darabok keletkeznek, amelyek agaróz gélen diszkrét, elkülönülő csíkokból álló sorozatot, úgynevezett apoptotikus létrát alkotnak.) A kaszpáz aktiváció következtében a DNS sérülések helyreállításában (DNS repaire) nélkülözhetetlen folyamatok is károsodnak (l. PARP (polyADP-ribose polymerase) inaktiválása kaszpáz-3 által, 15. ábra), s ez tovább fokozza a CAD tevékenységének hatását. A keletkező kis DNS szakaszok a p53 aktivitásának fokozásához vezetnek (16. és 37. ábra).
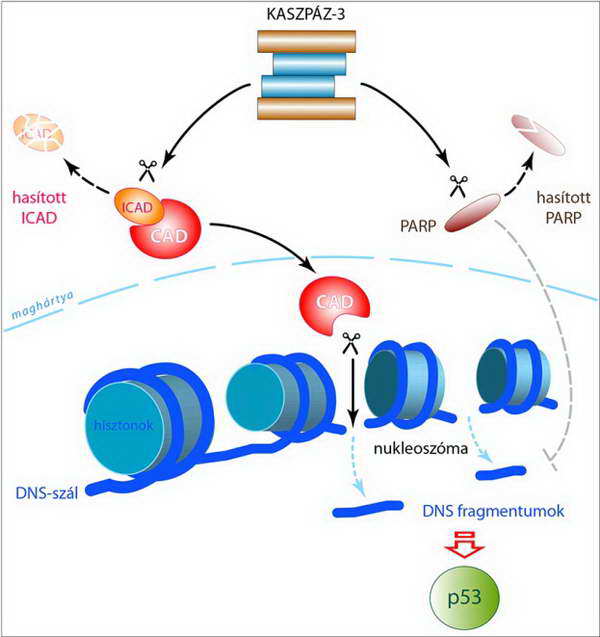
16. ábra A kaszpáz-3 és a CAD szerepe a DNS fragmentációban: az ICAD hasításával felszabaduló CAD a magban oligonukleoszómális darabokra szabdalja szét a kromatin állományt, miközben a DNS-szál helyreállítását végző PARP kaszpáz-3 általi inaktivációja miatt nem tudja annak szerkezetét helyreállítani. A fragmentáció a p53 fehérje aktvitásának fokozódásához vezet (l. 37. ábra)
Külső jelmolekulák által aktivált sejthalál útvonal az úgynevezett granzyme-B útvonal is. A granzyme-B citotoxikus T-sejtek által termelt proteolitikus enzim, amely kaszpáz jellegű aktivitással rendelkezik. A T-sejt ezt az enzimet a célsejt membránjához való kötődése után juttatja be annak citoplazmájába. A bejuttatás mechanizmusa még ma sem tisztázott, elfogadott tény azonban, hogy ebben a T-sejtből származó perforin molekuláknak szerepe van.
A sejtbe került granzyme-B enzim iniciátor kaszpázként működik, aktiválja a prokaszpáz-7 és prokaszpáz-3 enzimeket. A kaszpáz-3 olyan folyamatokat indít be, amelyek a sejtváz és a magszerkezet széteséséhez és a kromatin állomány fragmentációjához vezetnek (17. ábra).
Egyes kísérleti adatok szerint a granzyme-B citoplazmatikus szubsztrátumai közé tartozhat a Bcl-2 fehérjecsalád egyik pro-apoptotikus tagja a Bid is (21. ábra). A hasított Bid (tBid, truncated Bid) a mitokondriális sejthalál útvonal aktiválásában vesz részt. Ahogy azt később látni fogjuk, ez megadja a kegyelemdöfést a célsejtnek, mivel a mitokondriumokból számos pro-apototikus fehérje kerül ki a citoplazmába, s ez rendkívüli módon felerősíti és visszafordíthatatlanná teszi a sejtpusztuláshoz vezető folyamatokat (erről l. „A külső és a belső halálszignál útvonal összekapcsolása” c. fejezetet).
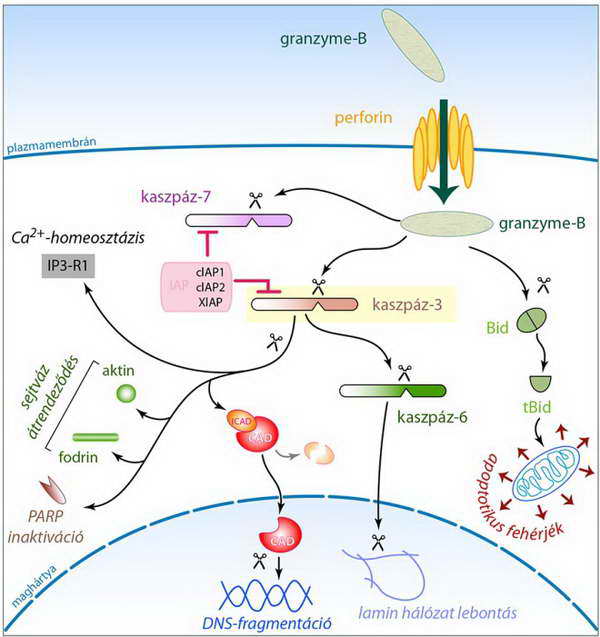
17. ábra A sejtbe került granzyme-B enzim iniciátor kaszpázként működik, aktiválja a prokaszpáz-7 és prokaszpáz-3 enzimeket. A kaszpáz-3 olyan folyamatokat indít be, amelyek a sejtváz és a magszerkezet széteséséhez és a kromatin állomány fragmentációjához vezetnek. Feltehetően szerepe van a Bid hasításában, így a mitokondriális sejthalál útvonal aktiválásában is. Az utóbbi eredményeként a mitokondriumból apoptotikus fehérjék szabadulnak ki a citoplazmába (az ábra közepén rózsaszín négyzetben látható IAP fehérje család tagjairól l. a 3.2.5.1. fejezetet)
Az apoptotikus kaszpáz-kaszkád másik, belső útvonalán az egyik inciátor kaszpáz a kaszpáz-9. Ennek aktiválása szintén egy nagy, több komponensű molekuláris komplexum, az úgynevezett apoptoszóma révén zajlik. Ez a komplexum a citoplazmában szerelődik össze, mégpedig egyrészt az apoptotikus stimulusok (oxidatív stressz, szubnekrotikus Ca2+ szint) hatására a mitokondriumokból felszabaduló citokróm-c, és a citoplazmában prekurzor formában jelenlévő Apaf-1 (apoptotic-enzyme activating factor), valamint pro-kaszpáz-9 molekulákból. A komplexum kialakulásához ATP hidrolízisre és nukleotid cserére (ADP/ATP) is szükség van. Az apoptoszóma felépítését és funkcionális szerkezetét a 19. és 20. ábrák mutatják be.
Az Apaf-1 molekula több fontos funkcionális régióval is rendelkezik. Az N-terminálisán található egy CARD interakciós domén, ahová bizonyos körülmények között hasonló régióval rendelkező iniciátor prokaszpáz (prokaszpáz-9) tud kötődni. A középső régióban egy nukleotid-kötő domén (NBD: nucleotide binding domain) helyezkedik el, ami ADP/ATP kötésre alkalmas, míg a C-terminális régiót egy hosszú, WD-40 repetitív szekvencia (WDR) alkotja (18. ábra)
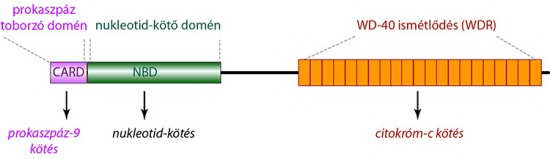
18. ábra Az Apaf-1 doménjei
Az inaktív Apaf-1 igen zárt térszerkezetét legjobban egy saját farkába harapó kígyó hasonlattal lehet szemléltetni, ahol a C-terminális WD-40 repetitív régió által alkotott „állkapocs” fogva tartja az N-terminális CARD régióját, lehetetlenné téve ezzel a pro-kaszpáz-9 bekötését (autoinhibíció, 19. ábra).
Ebből az inaktív állapotból csak apoptotikus stimulus hatására léphet ki az Apaf-1, mégpedig akkor, amikor az NBD régióhoz kötődő ATP-t elhidrolizálja. Ennek hatására az „állkapocs” szorítása lazul, s a mitokondriumokból kiszabaduló citokróm-c (ez egyben az apoptotikus jel) „felpeckeli” az „állkapcsot”. A folyamat során az Apaf-1 zárt konformációja teljesen átalakul, és egy ADP/ATP nukleotid-cserét követően 7 darab Apaf-1–citokróm c–ATP egységből álló, sugaras szimmetriájú komplex alakul ki. Amennyiben nukleotid csere nem történik, a sugaras szimmetria nem alakul ki – ez esetben prokaszpáz molekulák bekötésére sincsen lehetőség (20. ábra).
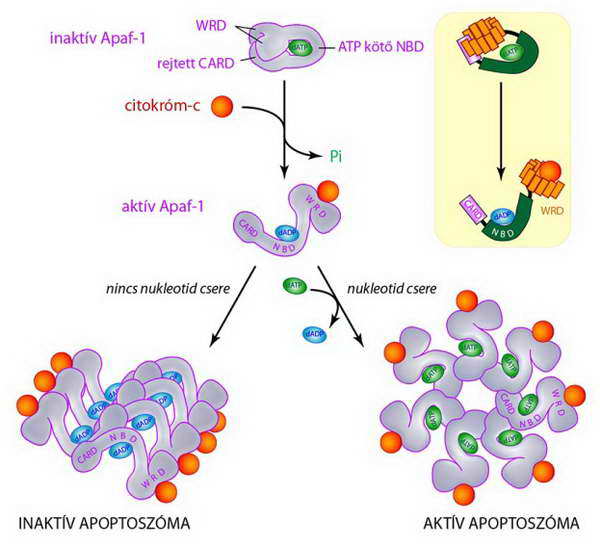
19. ábra Az Apaf-1 aktiválódása és apoptoszómává szerveződése. A sárga mezőben látható molekulamodellek a 18. ábrának megfelelően mutatják a tőlük balra látható konformációt
Az aktív apoptoszómában a kaszpáz-toborzó CARD régió hozzáférhető, így lehetőség van a prokaszpáz-9 molekulák bekötésére és aktiválódására. Ezzel kialakul a proteolitikusan aktív apoptoszóma (20. ábra). Az aktivált kaszpáz-9 molekulák (hasonlóan a kaszpáz-8-hoz, l. 14. ábra) limitált hasítással effektor prokaszpázokat aktiválnak.
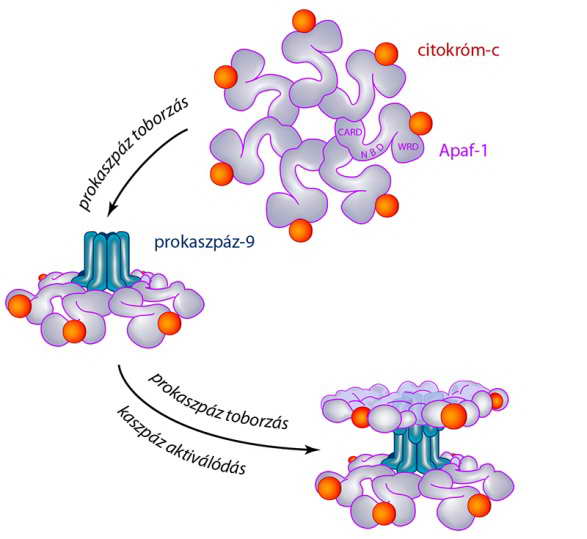
20. ábra A prokaszpáz-9 apoptoszómába épülése és a proteolitikusan aktív komplex kialakulása
A mitokondrium-közvetítette (belső) sejthalál útvonal kivitelezésében és szabályozásában alapvető szerepet töltenek be a Bcl-2 molekula család tagjai.
Az erős evolúciós konzervativizmust mutató molekula család első tagját, a Bcl-2 fehérjét B-sejtes lymphomából izolálták, mint protoonkogént. A Bcl-2 molekulában összesen 4 különböző, jellegzetes, alpha-helix dominanciájú, konzervatív szekvencia található.
A Bcl-2 molekulában összesen 4 különböző, jellegzetes, alpha-helix dominanciájú, konzervatív szekvencia található. A Bcl-2 fehérjecsaládba olyan molekulák tartoznak, amelyek rendelkeznek legalább egy ilyen, úgynevezett Bcl-2 homológia (BH-) doménnel. A szerkezeti homológia és az apoptózisban betöltött funkció alapján ma már több mint 20 fehérjét sorolunk ebbe a családba. A molekula család szerkezeti és funkcionális csoportosítása jól korrelál egymással (21. ábra).
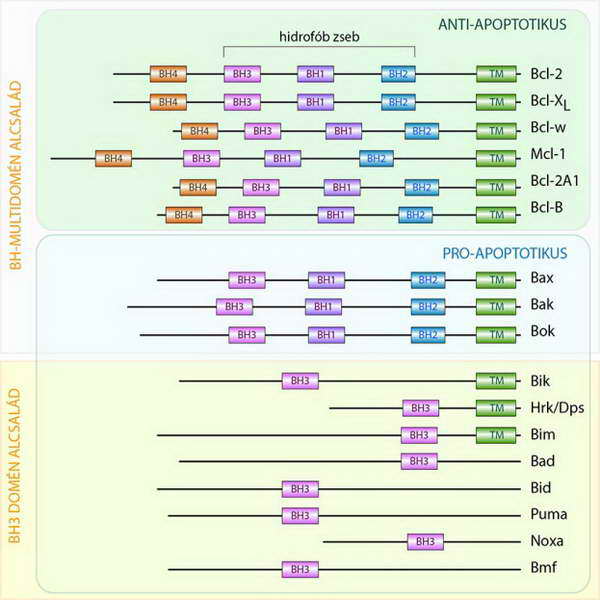
21. ábra A Bcl-2 fehérjecsalád tagjainak szerkezeti és funkcionális felosztása (BH: Bcl-2 homológ domén, TM: transzmembrán domén)
Az anti-apoptotikus hatású molekulák mutatják a legnagyobb szekvencia homológiát a Bcl-2 molekulával, mivel rendelkeznek valamennyi Bcl-2 homológia doménnel (BH1, BH2, BH3, BH4). Közös jellemzőjük továbbá, hogy a C-terminálisukon található egy hidrofób transzmembrán (TM) régió, amely nagymértékben meghatározza a sejten belüli lokalizációjukat (főként mitokondrium külső membrán, endoplazmatikus retikulum és sejtmag membrán).
A pro-apoptotikus családtagok a Bcl-2 homológia doménjük száma alapján további két alcsoportba oszthatók. Ezek a BH1–3 régióval rendelkező úgynevezett BH-multidoménű fehérjék és a csak BH3 domént tartalmazó, úgynevezett „BH3 only” proteinek. A pro-apoptotikus Bcl-2 családtagok közül a multidoménnel rendelkezők mindegyikének van TM régiója, míg a „csak BH3” fehérjék közül csupán egyeseknek.
A mitokondriumok alakjáról és szerkezetéről – elsősorban fixált szöveti- és sejtmintákon végzett morfológiai megfigyelések alapján – korábban alkotott képünket jelentősen módosították az elmúlt évek korszerű elektronmikroszkópos, immuncitokémiai, membrán fiziológiai és biokémiai vizsgálatai, valamint az in vivo megfigyelések céljára kifejlesztett mitokondriális marker, vitális fluoreszcens festékek (mitotracker) és fluoreszcens fúziós fehérje konstrukciók alkalmazása.
Már korábban is használtuk a sejt „mitokondrium rendszere” (mitochondrial system) szókapcsolatot, de az új ismeretek birtokában egyre gyakrabban találkozunk a szakirodalomban a mitokondriális hálózat (mitochondrial network) kifejezéssel. Való igaz – különösen a nagy metabolikus aktivitású, vagy erősen differenciált és polarizált sejtekre, mint például az izom- és idegsejtek –, hogy aktív működésük során a mitokondriumaik egy kiterjedt, elektromos és energetikai „kábelrendszerből” álló hálózatot alkotnak, amely nagyon szépen kirajzolódik ezen sejtekben a vitális mitotracker festés után (22.A ábra).
Bizonyos körülmények között a hálózat fragmentálódik, s a tankönyvekből jól ismert bab alakú szemcsékre esik szét (22.B ábra). A mitokondriumok görög eredetű tudományos neve arra utal, hogy erre a morfológiai lehetőségre már a sejtszervecske leírói is felfigyeltek, hiszen a név a mitosz=fonál és a kondrosz=szemcse szavak összevonásából ered.
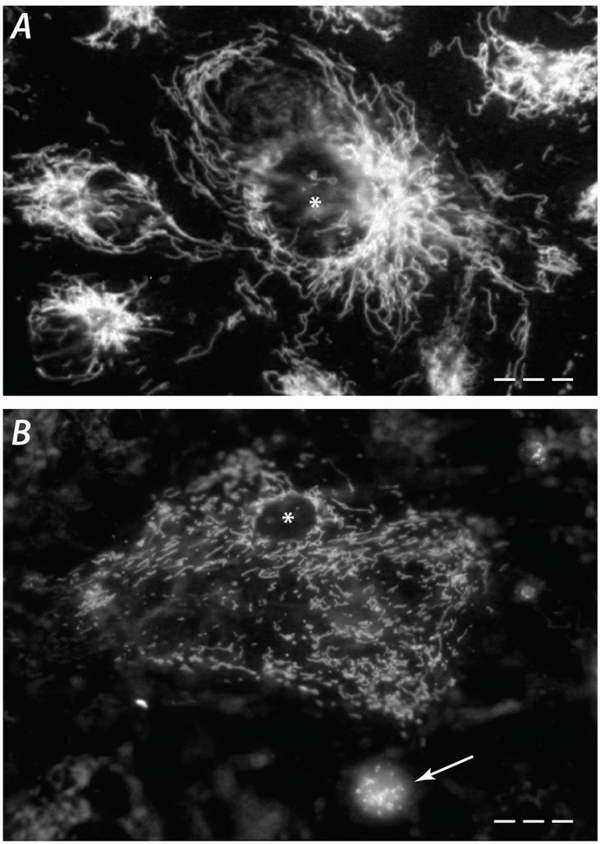
22. ábra Kiterjedt mitokondrium hálózat (A) és szétesett hálózat egyedi mitokondriumokkal apoptotikus sejtben (B) ugyanazon a nagyításon. (A mitokondriumokat mitotrackerrel jelöltük, ami egy vitális, mitokondrium-specifikus fluoreszcens festék. A csillagok a sejtmagot jelzik, amely az apoptotikus sejtben (B panel) zsugorodott; a nyíl egy rendkívül zsugorodott sejtre, vagy apoptotikus testre mutat.)
A hálózatos és a „szemcsés” formák fiziológiás körülmények között dinamikus egyensúlyban vannak egymással. A molekuláris sejtbiológiai kutatási módszerek fejlődésével fény derült a mitokondriumok fúziójáért és a fonalak fragmentálódásáért felelős molekuláris szereplőkre is. Ezeket, és a fúzió és lefűződéses szétválás („osztódás”) mikéntjét a 23. és a 24. ábra mutatja be.
A fúzióban kulcsszerepet játszó fehérjék a mitofuzinok (mitofusin, Mfn1/2). Transzmembrán (TM) régióik segítségével a mitokondrium külső membránjában rögzülnek, s alkothatnak homo- és heterodimereket egyaránt. A fúzió alkalmával a két egymáshoz megfelelő közelségbe került mitokondrium felszínén „egymással szemben állva” úgynevezett HR (heptad repeat) régióik révén kapcsolódnak össze (23.A ábra). A HR domének helikális szerkezetűek, s egymás mellé rendeződve képesek arra, hogy a mitofuzin GTP-áz doménjének közreműködésével (GTP hidrolízis) felszabaduló energiát a membránok közelítésére fordítsák. A folyamatot itt nem részletezzük, arra azonban felhívjuk a figyelmet, hogy a kettős membránnal határolt mitokondriumok fúziója szükségképpen kétlépéses folyamat, hiszen a külső membránok után a belsőknek is egyesülniük kell (23.B ábra).
Bizonyosnak látszik, hogy léteznek olyan fehérjék, amelyek a két membrán közötti kapcsolat kialakításában vesznek részt. Ilyen a dynamin[2] homológ Opa (optic atrophy), amelynek proteolítikus hasításával egy hosszabb, a belső membránhoz kötött, és egy rövidebb, az intermembrán térben mozgó formáját azonosították. Hogy ezek milyen módon alakítanak ki kapcsolatot a külső membránnal, esetleg az itt horgonyzó mitofuzin molekulákkal, az ma még nem kellőképpen tisztázott.
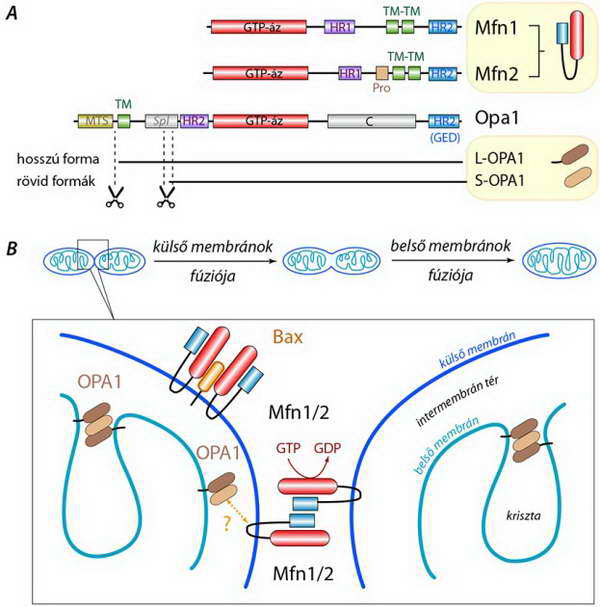
23. ábra Mitokondrium fúzió: a folyamatban résztvevő molekulák szerkezete (A) és a külső membránok fúziójának kezdeti lépése. Az ábrán jeleztük, hogy a belső membrán krisztáinak terét kriszta-kapcsoló struktúrák zárják le, amelyeknek egyik tagja az Opa1 fehérje hosszú és rövid formája által alkotott komplex (Mfn, OPA, HR, TM jelentését l. a szövegben, Pro: prolin gazdag domén, MTS: mitokondriális transzport szekvencia, Spl: alternatív mRNS-illesztésű domén, GED: GTP-áz effektor domén)
Az egyedi mitokondriumok olyan fonalas hálózatot hoznak létre, amelyben „individualitásuk” megszűnik. A hálózathoz folyamatosan csatlakoznak új tagok, s arról szintén folyamatosan le is válnak ismét egyedivé váló mitokondriumok. A fúzió mellett a dinamikus átépülést a rendszer fragmentálódása, régebbi felfogásban a mitokondriumok osztódása biztosítja, amely lényegében lefűződés, feldarabolódás.
A lefűződésben két központi szerepet játszó molekulát azonosítottak. A Fis1 (fission) protein transzmembrán (TM) doménje révén a mitokondrium felszínén rögzül. N-terminálisán két TPR (tetratricopeptide repeate) régiót hordoz, amelynek abban van szerepe, hogy a citoplazmából magához kösse a Drp1 (dynamin related protein 1) fehérjét. A Drp olyan nagyméretű GTP-áz, amely a dynaminhoz hasonló szerkezettel és funkcióval rendelkezik (24.A ábra). (A dynamin endoszómális vezikulák sejtmembránról történő lefűzésében játszik szerepet.)
A Drp1 citoplazmatikus fehérje, amely képes a mitokondrium felszínéhez kötődni, s úgy tűnik, hogy az élesztő sejtekkel szemben az emlős sejteknek ehhez nincsen szükségük adaptor, közvetítő fehérjékre: a Fis és a Drp1 egymáshoz kötődése közvetlen. A Drp mitokondriumhoz szállításában a sejtváz játszik szerepet (24.B–C ábrák).
A Fis1-Drp1 komplexek a mitokondriumon megjelenő kezdeti befűződés mentén sorakoznak fel úgy, hogy egy, a mitokondriumot átölelő gyűrűt képeznek, amely egyre szorosabbra húzódik, míg végül lefűz egy mitokondriumot a hálózatról (24.C–E ábrák). Annak mechanizmusa, hogy a belső membrán hogyan követi a külső membránban zajló eseményeket, s hogy az emlős sejtekben mi biztosítja ketté fűződését, kevés ismeretünk van. A folyamat egyik lehetséges résztvevője a fent említett Opa1, amely mint írtuk, szintén dynamin homológ.
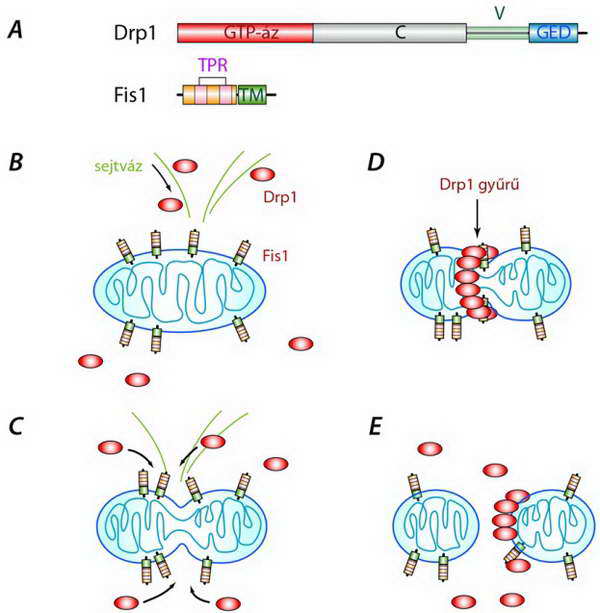
24. ábra Mitokondrium lefűződése (osztódása) vázlatosan: a folyamatban kulcsszerepet játszó Drp1 és Fis1 szerkezete (A) és az osztódás folyamata (B–E). B: a Drp1 a sejtváz közvetítésével jut a mitokondrium felszínéhez; C: megjelenik a kezdeti befűződés és a Drp1 molekulák hozzákötődnek a Fis1-hez; D: a Drp1–Fis1 komplexek a befűződés mentén sorakoznak fel; E: a mitokondrium kettéfűződik, a Drp1–Fis1 komplexek szétesnek. A rajzon azt nem jeleztük, hogy itt nem egy mitokondrium kettéfűződéséről, hanem egy mitokondrium hálózatról történő lefűződéséről van szó (C: centrális, V: variábilis, GED: GTP-áz effektor domén, TPR: tetratricopeptide repeate, Drp1, Fis1: l. szöveg)
A mitokondriumok szerkezetének és működésének minél alaposabb felderítését célzó finom ultrastruktúrális és membránpotenciál vizsgálatok egy másik érdekes (mint kiderült, funkcionálisan is fontos) morfológiai tényre hívták fel a figyelmet.
A mitokondrium külső membránja és a belső membrán közötti intermembrán tér, valamint a belső membrán által határolt mátrix téren kívül, a krisztáknak az intermembrán tértől való reverzibilis lehatárolódásával kialakulhat egy harmadik, úgynevezett interkrisztális tér is. A kriszták lemezeinek a külső membrán felöli szélét kriszta-kapcsoló struktúrák (crista junction) kötik össze egymással, amelyeknek a pontos szerkezete még nem ismert. Az egyik molekuláris komponensét azonban egyértelműen azonosították, s ez érdekes módon a mitokondrium hálózat dinamikus átrendeződésének egyik ismert szereplője, az Opa1 (23. ábra).
Az apoptózis morfológiájával alaposabban foglalkozó kutatók érdekes megfigyelése volt az, hogy azokban a sejtekben, amelyekről kiderült, hogy később apoptózissal pusztulnak el, a tipikus apoptotikus morfológiai bélyegek megjelenése előtt jelentősen megnő a mitokondriumok száma. Ezt a jelenséget azzal próbálták magyarázni, hogy a sejt a fokozódó stresszre erőteljes és valódi mitokondrium osztódással reagál, megnövelve ezzel a védekezéshez szükséges energiatermelő kapacitását. Ma már tudjuk, hogy a számbeli növekedés valójában inkább a mitokondriális hálózatot alkotó fonalas mitokondriumok kicsi „szemcsékké” történő fragmentálódásának a következménye.
Az apoptotikus pusztulás sorsára jutott sejt mitokondriális állományának relatív citoplazmatikus térfogataránya azonban nem növekszik; sőt, a folyamat előre haladtával – a mitokondriumok zsugorodása és a sérült, „védtelen”, kisméretű mitokondriumok szelektív autofágiája (mitofágia) miatt – jelentősen csökken. (Többek között ez a magyarázata az apoptózis során fellépő fokozott energiahiánynak.)
Ma már azt is tudjuk, hogy egy kedvező fiziológiás körülmények között működő sejt esetében az ép mitokondriumokban a kriszta-kapcsoló struktúrák zártak és a belső membrán külső felszínéhez kötődő citokróm c molekulák nagy része az interkrisztális térben található (25. ábra). A kriszta-kapcsoló struktúrák zárt és nyitott állapota is dinamikusan változhat, és ez szoros összefüggésben áll a mitokondriális hálózat fragmentációjával.
Már a fenti, elsősorban morfológiai vizsgálatokból származó megfigyelések alapján egyre izgalmasabbá vált az a tudományos felvetés, hogy a mitokondriumok nem csak a földi élet oxidatív környezetéhez alkalmazkodott eukarióta sejtek életjelenségeihez szükséges energia előállításáért felelősek, hanem kulcsszerepet játszanak „befogadó gazdájuk” kivégzésében is.
A legújabb kísérletes kutatások egyre meggyőzőbb molekuláris sejtbiológiai bizonyítékokat szolgáltatnak arra, hogy az aktív sejthalál apoptotikus típusában, annak kaszpáz-függő és kaszpáz-független útvonalaiban egyaránt (l. következő fejezet), a mitokondriumok szerepe szó szerint (sejt)sorsdöntő!
Az intracelluláris sejthalál stimulusok nagy része a kiterjedt mitokondriális hálózat membránján gyűlik össze. A hosszú, fonalas és a kicsi, lefűződött mitokondriumok dinamikus egyensúlya megbomlik és eltolódik a fragmentáció irányába (22. ábra). Ezzel egyrészt megnő a károsító hatásnak kitett membrán felület, másrészt a kicsi, egyedi mitokondriumok sokkal kiszolgáltatottabbak és védtelenebbek a károsító stimulusokkal szemben, mint maga a hálózat.
A mitokondriális külső membrán mindenkori állapotáért, intaktságáért, áteresztőképességének változásáért a már korábban megismert Bcl-2 molekula család transzmembrán régióval is rendelkező anti- és pro-apoptotikus tagjai a felelősek (21. ábra). Nem lehet véletlen tehát az, hogy a mitokondrium fúzióban és lefűződéses szétválásban kulcsszerepet játszó molekulákon (Mfn1/2, Opa1, Fis1, Drp1) kívül a hálózat stabilitásában, illetve annak felbomlásában ezen fehérjecsalád tagjait is megtaláljuk (25. ábra).
A mitokondriális külső membrán mindenkori állapotáért, intaktságáért, áteresztőképességének változásáért a már korábban megismert Bcl-2 molekula család transzmembrán régióval is rendelkező anti- és pro-apoptotikus tagjai a felelősek (21. ábra). Nem lehet véletlen tehát az, hogy a mitokondrium fúzióban és lefűződéses szétválásban kulcsszerepet játszó molekulákon (Mfn1/2, Opa1, Fis1, Drp1) kívül a hálózat stabilitásában, illetve annak felbomlásában ezen fehérje család tagjait is megtaláljuk (25. ábra). A mitokondriális hálózat viszonylag gyors és irreverzibilis szétesése azonban „csak” szükséges, de nem elégséges feltétele a mitokondriális sejthalál útvonalak felpörgésének.
A mitokondriumok számos olyan fehérjét „őriznek” intramembrán terükben, amelyek az egészséges sejtben hasznos funkciót töltenek be, a citoplazmába kijutva azonban apoptogén (apoptózist indukáló) hatásúak. A sejt élete szempontjából tehát alapvető fontosságú az, hogy ezek a molekulák ne kerülhessenek ki a citoplazmába. Közülük csak a legfontosabbakat említve ide tartozik a citokróm c, az AIF, az endonukleáz G, a Smac és az Omi, amelyek a rendeltetési helyükként szolgáló mitokondrium „fogságából” kijutva – a sejthalál előidézése érdekében – átfogó hadműveletekbe kezdenek (hatásukról a következő fejezetben lesz szó). Az apoptózis mitokondriális útvonalának kezdő lépése, azaz a mitokondriális hálózat gyors és irreverzibilis szétesése után az igazi, lényegi kérdés tehát az, hogy ezek az apoptogén molekulák hogyan jutnak ki a citoplazmába.
A mitokondrium terének citoplazmától való elszigeteltségét a külső membrán épsége biztosítja. Erre a Bcl-2 fehérje család anti-apoptotikus tagjai „vigyáznak”. A névadó Bcl-2 és a Bcl-XL homodimer formában vannak itt jelen, de arra is képesek, hogy heterodimereket alkossanak a család olyan pro-apoptotikus tagjaival, amelyek transzmembrán doménnel is rendelkeznek, így szintén membránkötöttek – ilyen például a Bak (l. 21. ábra). Amíg az anti- és a multidoménű pro-apoptotikus Bcl fehérjék egyensúlya megfelelő, a pro-apoptotikus proteinek nem áll(hat)nak össze homodimerekké, s nem fejthetik ki hatásukat (25.A ábra).
Amint ez az egyensúly valamilyen okból kifolyólag megbomlik, s a homodimerizációra lehetőség nyílik, a külső membrán integritása megszűnik, mivel rajta olyan pórusok nyílnak, amelyek a fent említett apoptogén fehérjék kijutását lehetővé teszik. Az átrendeződést olyan pro-apoptotikus Bcl-2 család tagok indukálják, amelyek a citoplazmából „érkeznek”. Ezek a „csak BH3” doménnel rendelkező fehérjék (l. 21. ábra) kétféle módon fejthetik ki hatásukat. Egyesek hozzákötődnek az anti-apoptotikus fehérjékhez, ezzel kivonják őket a pro-apoptotikus társakkal alkotott heterodimerből, aminek következtében azok homodimereket alkothatnak. A másik lehetőség az az, hogy a „csak BH3” doménnel rendelkező fehérje egy másik, multidoménű pro-apoptotikus családtaghoz kötődik, s megváltoztatva annak konformációját, képessé teszi azt a mitokondriális membránhoz való kötődésre. Ezzel tulajdonképpen elbillenti az egyensúlyt a pro-apoptotikus fehérjék javára, aminek az lesz a következménye, hogy a fölénybe került pro-apoptotikus molekulák egyre nagyobb számú homodimert képezhetnek (25. ábra).
A Bid egy olyan „csak BH3” doménnel rendelkező Bcl családtag, aminek csonkolt formája (tBid) egyrészt képes a Bcl-2 megkötésére (ezzel elvonja azt a Bcl-2–Bak heterodimerből), másrészt pedig a Bax konformációjának oly módon történő átrendezésére, hogy az képes legyen a mitokondrium membránba inzertálódni (25.B ábra). (Hasonlóan kettős hatású a Bim és a Puma.)
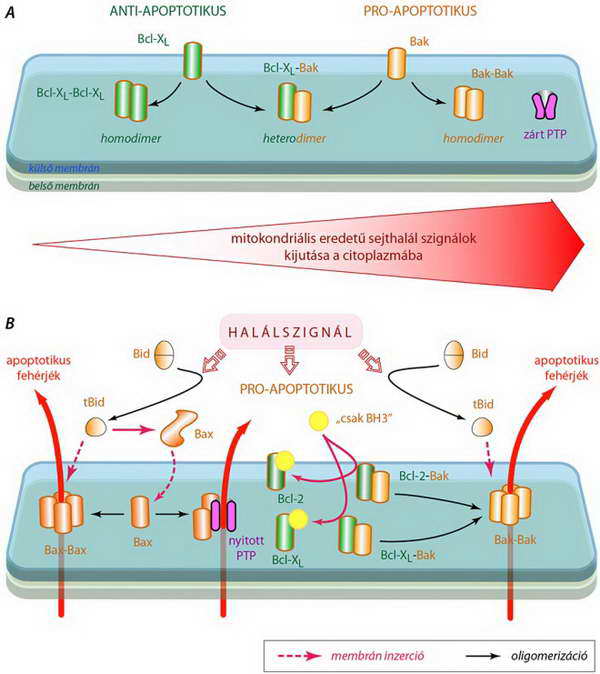
25. ábra A mitokondrium külső membránjában lokalizálódó fehérjék és az apoptitikus szignálok hatása a Bcl-2 fehérje család tagjai által képzett homo- és heterodimerek egyensúlyára, valamint a membránpórusok (PTP) kialakulására (részletes magyarázat a szövegben)
A proapototikus homodimerek nagyszámú megjelenése a mitokondrium membránjának permeabilitását drasztikusan megváltoztatja: a membránon permeabilitási tranzíciós pórusok (PTP) más néven MOMP (mitochondrial outer membrane pore) nyílnak, amelyeken keresztül az apoptogén faktorok kijutnak a citoplazmába. Az, hogy e pórusokat pontosan milyen fehérjék és milyen összetételben alkotják, még nem ismert. Elképzelhető, hogy azokat maguk a pro-apoptotikus Bcl-2 fehérjék képezik, de arra is vannak adatok, hogy csak hozzájárulnak e pórusok nyitásához (25.B ábra).
A mitokondriális fragmentáció és a külső membránban zajló események hatással vannak a belső membrán stabilitására is: a kriszta-kapcsoló struktúrák felbomlanak, ezért az interkrisztális térből nagy mennyiségű citokróm c áramlik az intermembrán térbe, ami onnan a megnyílt pórusokon keresztül kijut a citoplazmába (26. ábra). Hasonló módon történhet az AIF, az endonukleáz G, a IAP-gátló Smac (l. „A IAP fehérjecsalád” c. fejezet ) és Omi kijutása is.
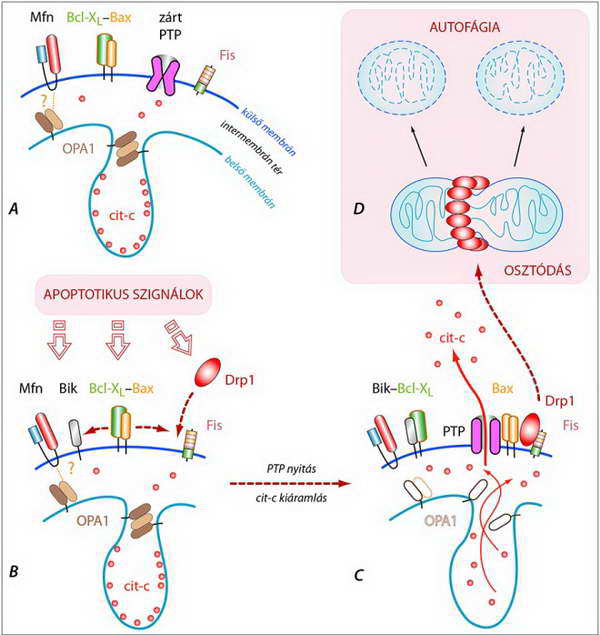
26. ábra. A kriszta-kapcsoló struktúrák felbomlása és a citokróm c (cit-c) mitokondriumból történő kiáramlásának mechanizmusa (magyarázat a szövegben) (rövidítéseket l. a szövegben, Bik: „csak BH3” fehérje, l. 21. ábra)
Az apoptózis mitokondriális útvonalát indukáló stimulusok valamennyien a Bcl-2 család „csak BH3” tagjainak közvetítésével fejtik ki hatásukat. Ezen BH3 fehérjék aktiválása különböző módon történik, többnyire poszttranszlációs módosítással (Bad, Bim: defoszforláció, Bid: részleges proteolízis) vagy az expressziójuk közvetlen fokozásával (Noxa, Puma, HRK: harakiri Bcl-2 interactiv protein). Ezektől eltérő módon a Bim, amely egy mikrotubulus vázhoz kötött fehérje, a sejtváz dezintegrációja következtében kerülhet kapcsolatba a mitokondriummal (27. ábra).
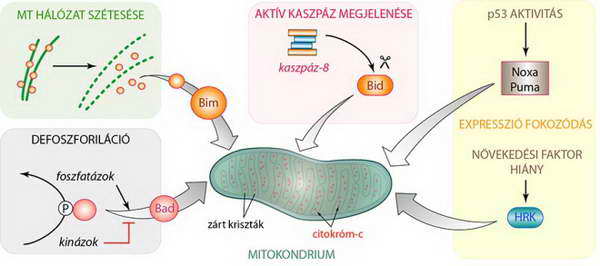
27. ábra. Az apoptózis mitokondriális útvonalát beindító „csak BH3” fehérjék aktiválásának módjai a transzlokáció, a foszforiláció, a limitált proteolízis és az expresszió fokozása
A mitokondriális sejthalál kaszpáz függő mechanizmusa a mitokondriumokból nagymennyiségben kiszabaduló citokróm c közvetítésével aktiválódik. A citokróm c a citoplazmában inaktív formában lévő Apaf-1 fehérjéhez kötődve iniciálja az apoptoszóma összeszerelődését (l. 19. ábra), ezen keresztül a prokaszpáz-9 iniciátor kaszpáz és effektor kaszpázok aktiválódását.
Az apoptózist kiváltó stimulusok a főcsapást jelentő kaszpáz-kaszkádokon kívül más molekuláris komponensek révén is hozzájárulhatnak azonban a sejt aktív elhalásához.
A mitokondriális membrán permeabilizálódása következményeként a mitokondriumokból nem csak a kaszpáz aktivációban szerepet játszó citokróm-c jut ki a citoplazmába, hanem más fehérjék is, mint például az AIF (apoptosis-inducing factor) és az endonukleáz G (28. ábra).
Az AIF egy oxido-reduktáz funkciójú flavoprotein, amely normális körülmények között a mitokondriális intermembrán térben található. Miután azonban a mitokondriális lokalizációs szignálon (MLS) kívül magi (nukleáris) lokalizációs szekvenciája (NLS) is van, nem meglepő, hogy a citoplazmába kerülve onnan a sejtmagba transzlokákódik.
Az AIF a sejtmagban a ciklofilin-A-val molekuláris komplexeket, úgynevezett degradoszómákat képezve részt vesz a DNS fragmentálásában. Az endonukleáz G a sejtmagba jutva hasonló szerepet játszik (28. ábra).
A mitokondriumokból kijutó Omi/HtrA2 (high temperature-requirement protein A2) nem csak a IAP-ok gátlását végzi (28. ábra), hanem szerin proteáz aktivitása révén maga is képes pro-apoptotikus fehérjék limitált proteolízissel történő aktiválására.
A citoplazmatikus Ca2+ koncentráció pro-apoptotikus szintre emelkedése olyan Ca2+-függő molekulákat aktiválhat, amelyeknek fontos szerepe lehet az apoptózisban. Az intracelluláris Ca2+-szint emelkedés elsősorban az endoplazmatikus retikulumot (ER) ért stressz következménye (l. 15. és 17. ábra).
Ezek a folyamatok azonban nem tekinthetők egyértelműen kaszpáz függetlennek. A szerin proteáz Ca2+-függő kalpainok ugyanis közvetlenül aktiválhatnak effektor kaszpázokat, míg a kalcineurin foszfatázként a pro-apoptotikus Bad fehérjét (Bcl család, „csak BH3) defoszforilálja és aktiválja. Ez utóbbi viszont mitokondriális közvetítéssel zajló kaszpáz aktivációhoz vezet (27. ábra).
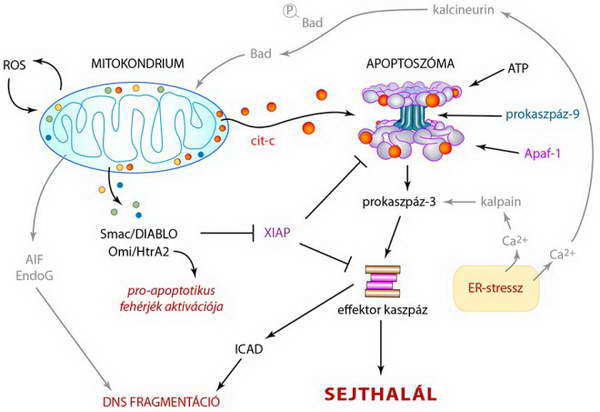
28. ábra. A mitokondriális sejthalál kaszpáz-függő és kaszpáz-független útvonalainak összefonódása: az előbbit fekete, az utóbbit szürke nyilak és feliratok jelzik (a magyarázatot l. a szövegben) (cit-c: citokróm c, ER: endoplazmatikus retikulum, ROS: reaktív oxidatív szabadgyök , a többi rövidítést a szöveg tartalmazza)
Amint látjuk, a sejt többnyire a külső és belső kényszerítő körülményeknek – a továbbiakban már elviselhetetlen és a környező sejteket is veszélyeztető – hatására szánja rá magát az önpusztító lépésre. A „visszavonhatatlan döntés” meghozatala után az egész folyamat óramű pontossággal, a fogaskerekek tökéletes illeszkedésével zajlik. A rendszerbe a „véletlen menekvés” esélyének minimalizálása érdekében számos kapcsoló és jelerősítő (amplifikáló) útvonal van beépítve. Ennek egyik szép példája a külső (extrinsic), halál receptorról induló apoptotikus útvonal és a belső (intrinsic), mitokondriális útvonal összekapcsolása az exekuciót végző effektor kaszpázok megfelelő mértékű aktiválása érdekében.
A folyamatban a jelkapcsoló molekula szerepét egy „csak BH3” fehérje, a Bid tölti be, aminek a citoplazmában található inaktív formáját proteolítikus hasítással lehet aktiválni. A Bid csonkolására több olyan enzim is képes, amelyek fontos szerepet töltenek be az apoptózis mechanizmusában, így a Ca2+-függő kalpain (l. 28. ábra), a granzyme-B (17. ábra) és két iniciátor kaszpáz, a kaszpáz-2 és -8 (12. ábra).
Amennyiben a prokaszpáz-8 DISC-hez kötött aktiválása során nem keletkezik elegendő mennyiségű aktív kaszpáz-8 molekula az effektor kaszpázok közvetlen aktiválásához, a kaszpáz-8 a Bid-et hasítja. A csonkolt Bid (tBid), mint aktív „BH3 only” protein az anti-apoptotikus Bcl-2-t és a Bcl-XL-t gátolva, illetve a pro-apoptotikus Bax és Bak molekulák homodimerizációját ösztönözve, serkenti a citokróm c molekulák mitokondriumból citoplazmába irányuló kiáramlását. Itt ennek hatására a már korábban leírt prokaszpáz-9 és Apaf-1 molekulákból aktív apoptoszómák szerveződnek (19. ábra), amelyek felsokszorozzák az aktív iniciátor kaszpázok mennyiségét, és a folyamat így tovább gördülhet egészen a sejt teljes megsemmisüléséig.
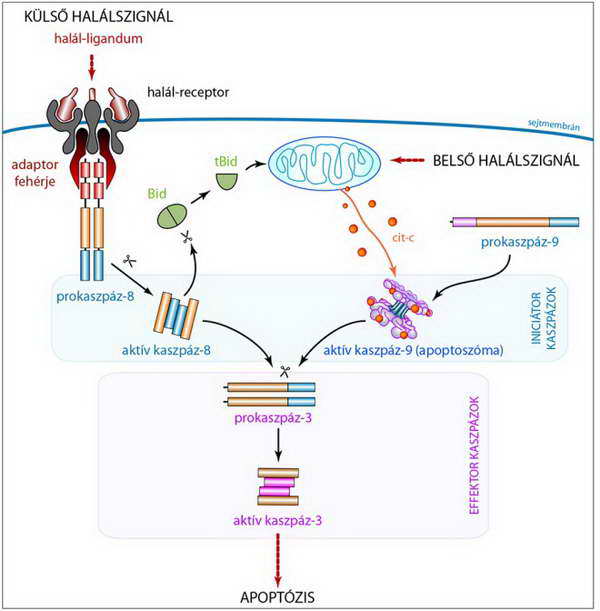
29. ábra. A Bid szerepe a külső és belső halálszignálok által aktivált útvonalak összekapcsolásában, a „jelerősítésben”: a halál receptorhoz adaptor fehérjével kötődő prokaszpáz-8 aktiválódás után nem csak effektor kaszpázt képes aktiválni, hanem elhasítja a Bid-et is. A csonkolt Bid (tBid) a mitokondrium membránjához kötődve (l. 26. ábra) hozzájárul a citokróm c (cit-c) citoplazmába történő kiáramlásához, ezzel az apoptoszóma aktiválásához, végső soron a kaszpáz rendszer működésének felerősítéséhez
A IAP (inhibitors of apoptotic proteins) fehérje család első tagját (OpIAP) bakulovírusból izolálták, mint olyan fehérjét, amelynek az a szerepe, hogy meggátolja a gazdasejt önpusztító védelmi reakcióját, s minél hosszabb ideig biztosítsa a vírus teljes replikációját. A későbbiekben a gerinctelenektől az emlősökig számos olyan molekulát fedeztek fel, amelyek funkció és szerkezeti hasonlóság alapján is egy csoportba sorolhatók az OpIAP molekulával.
Valamennyiük szerkezetében közös, hogy rendelkeznek legalább egy, úgynevezett BIR (baculovirus IAP-repeat) régióval és egy RING (really interesting new gene)-finger vagy UBC (ubiquitin conjugating) doménnel (30. ábra).
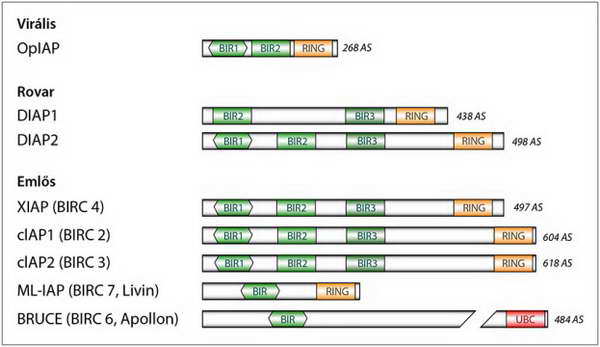
30. ábra. A IAP fehérjecsalád tagjainak szerkezete (BIR, RING, UBC rövidítések jelentését l. a szövegben)
A BIR domének valódi enzim-gátló tulajdonsággal rendelkeznek, és a már aktivált iniciátor és effektor kaszpázok működését blokkolják (31. ábra). A RING-finger és UBC régiók révén a IAP-ok ubikvitin-ligázként (E3, az ubikvitin konjugáló enzimsor utolsó tagja) poli-ubikvitin lánccal specifikusan megjelölve a zimogén és aktív kaszpázokat, azokat proteaszómális lebontásra ítélik. Mindkét mechanizmus alapvetően anti-apoptotikus hatású, de míg az előbbi (BIR domének működése) többnyire reverzibilis, az utóbbi (poli-ubikvitináció) visszafordíthatatlan (32. ábra).
Egyes emlős IAP-okon (cIAP1, 2) zimogén kaszpáz rekrutáló (CARD) régió is található, amely révén a hasonló prodoménű iniciátor prokaszpázokhoz (kaszpáz-2, -9) kötve meggátolják azok aktivációját (31. ábra). Elmondható tehát, hogy a IAP-családba tartozó fehérjék valamennyi kaszpáz-függő sejthalál útvonalat képesek gátolni.
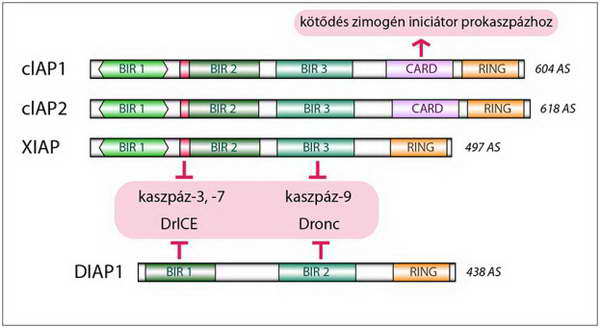
31. ábra. A IAP család reprezentatív tagjai és azok funkcionális régiói: a BIR domének enzimgátlók, a CARD régiók iniciátor prokaszpáz toborzók (az ábra alján szereplő DIAP Drosophila IAP)
A IAP-ok ubikvitin-ligáz aktivitása alapján azonban az is lehetséges, hogy egymást poli-ubikvitinálják, és így az ubikvitin-proteaszóma rendszer révén szabályozzák saját koncentrációjukat, szabad utat adva ezzel az apoptózis folyamatának (32. ábra).
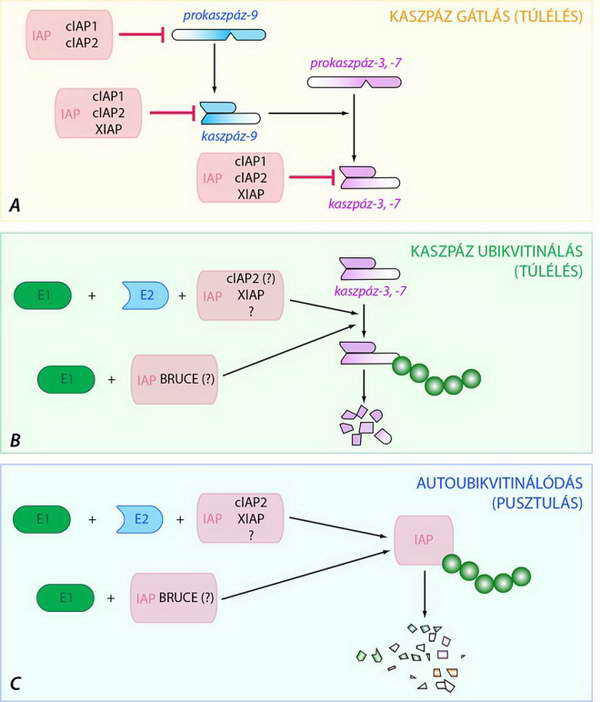
A IAP fehérjék sokirányú lehetőségei az apoptotikus sejthalál szabályozásában (a magyarázatot a szöveg tartalmazza)
Egy sejt nyugalmi, „építkező” állapotára – többek között – az jellemző, hogy a citoplazmában a IAP család tagjai „féken tartják” a kaszpázokat. Amíg a sejtet csak szub-apoptotikus stressz-hatások érik, ez az egyensúly fenn is marad.
Amint azonban olyan mértékű stressz éri a sejtet, ami aktiválni képes a mitokondriális (intrinsic) sejthalál útvonalat, a sérült mitokondriumokból kiáramló Smac/DIABLO (second mitochondria-derived activator of caspases/direct IAP-binding with low pI) és Omi/HtrA2 az evolúciósan konzervatív IAP-kötő régióik révén (33. ábra) gátolni tudják a IAP-ok működését (28. ábra). Ez a kaszpázok „gátlástalan” tobzódásához vezet, s a sejt, mint egy fékevesztett jármű a lejtőn, egyre gyorsuló sebességgel rohan a megsemmisülésbe.

33. ábra. Különböző, főként apoptózist stimuláló fehérjék IAP-kötő régiójának evolúciós konzervativizmusa: a nyolc tagból álló tetrapeptid motívumban (A-(V/T/I)-(P/A)-(F/Y/I/V)) zöld és sárga színnel a konzervatív aminosavakat jelöltük. Az ecetmuslicában egy további kötőhely is van, amely kékkel jelzett
A sejt genetikai állományát alkotó DNS molekulák a transzkripciós és a transzlációs útvonal révén központi szerepet töltenek be a sejt élettani folyamatainak irányításában, valamint az információk utódsejtekbe történő átadásában. A DNS károsodás tehát súlyos zavart okozhat a sejt egyedi működésében, ami végső esetben a sejt pusztulásához vezet. Ugyanakkor a sejt szabályozatlan és korlátlan osztódásához vezető úgynevezett malignus (rosszindulatú) transzformáció az egész szervezetet veszélyezteti.
Ezért nélkülözhetetlen a sejt DNS állományának szigorú védelme, szükség esetén károsodásainak helyreállítása (reparációja), végszükségben (a DNS visszafordíthatatlan károsodásakor) pedig a sejt „öngyilkossága”, azaz a halálba menekülés, az apoptózis. Érdekes módon a DNS károsodás olyan jelátviteli módokat aktivál, amelyeknek fő komponensei kinázok (pl. a PI3K–Akt útvonal). A biztonsági őr szerepét betöltő p53 fehérje az a transzkripciós faktor, amelynek aktivációja ezen kinázok által közvetített foszforiláció révén zajlik (34. ábra, I. táblázat). Az aktivált p53 számtalan, az apoptózisban kulcsszerepet játszó fehérje génjének átíródását szabályozza. Azon aminosavak (Ser), amelyeknek foszforilációja az aktív önmegsemmisítés stimulálását eredményezik, jellemzően a p53 molekula N-terminálisán helyezkednek el.
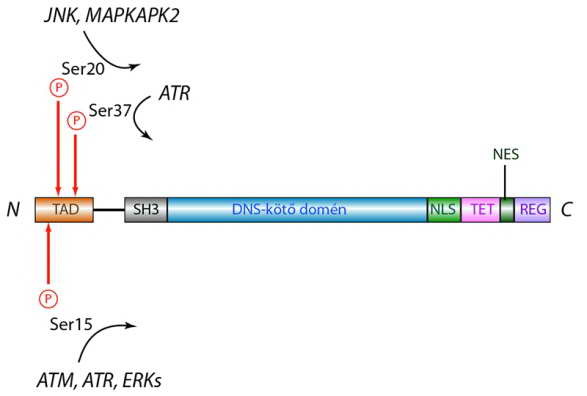
34. ábra. A p53 molekula szerkezete: az apoptózisban szerepet játszó foszforilációs helyek jellemzően az N-terminálison elhelyezkedő szerinek (ATM: ataxia talengiectasia mutated, ATR: ataxia talengiectasia and Rad3 related protein, JNK: c-JUN N-terminális kináz, MAPKAPK2: mitogén aktivált protein kináz-aktivált protein kináz 2, TAD: , transactivation domain, SH3: Src homology 3-like domain, NLS: magi lokalizációs szignál, NES: magi export szignál, TET: tetramerizációs domén, REG: C-terminális regulátor domén)
I. táblázat A p53 apoptotikus kimenettel járó foszforilációi (az enzimnevek rövidítéseinek jelentését l. a 34. ábra aláírásában)

A p53 elsősorban az apoptózis mitokondrium-függő útvonalának serkentésén keresztül fejti ki hatását. Egyrészt a Bcl-2 molekula család anti-apoptotikus tagjainak (Bcl-2, Bcl-XL) az expresszióját gátolja, ezáltal a mitokondriumokat kiszolgáltatottá teszi az apoptotikus hatásoknak. Másrészt az aktív (programozott) sejthalál kivitelezésében (Apaf1, Fas, Bax) vagy annak ösztönzésében (Bid, Noxa, Puma) résztvevő molekulák expresszióját stimulálja (37. ábra).
Az aktív p53 képes beindítani - egy, az apoptoszómához hasonló alapon szerveződő komplex, az úgynevezett PIDDoszóma (PIDDosome) összeszerelődésén keresztül - egy kaszpáz aktivációs sejthalál útvonalat is. Ennek a komplexnek a centrális molekulája a PIDD (p53-induced protein with death domain), amelynek expresszióját a p53 fokozza. A PIDD (a halál receptorokhoz hasonlóan, l. Fas) C-terminálisán (PIDD-CC) egy DD (death domén) szekvenciát hordoz, amely fehérje-fehérje kölcsönhatást alakíthat ki más DD részletet tartalmazó molekulával (35. ábra).
Az aktivált PIDD a citoplazmában lévő RAIDD (RIP-associated ICH-1/CAD-3 homologous protein with a death domain) adaptor fehérjét köti, mégpedig annak halál doménjén (DD) keresztül (35. ábra). Mivel a RAID N-terminálisa egy CARD domént hordoz, az adaptor fehérje prokaszpáz molekulákat képes toborozni a komplexbe.
A PIDDoszómába beépülő zimogén kaszpáz a prokaszpáz-9-hez hasonló szerkezetű prokaszpáz-2, amely szintén iniciátor kaszpáz (12. és 36. ábra).
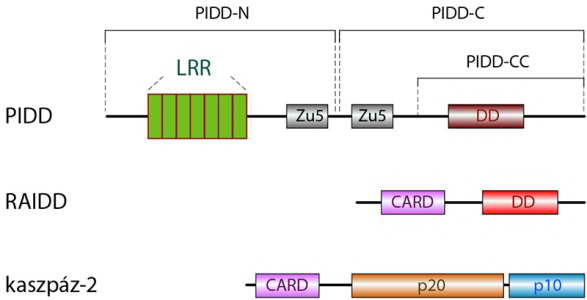
35. ábra.
A PIDDoszóma kialakításában résztvevő fehérjék szerkezete. A PIDD proteolitikus hasítással egy N- és egy C-terminálist tartalmazó részre (PIDD-N és PIDD-C) bontható. A PIDD-CC az utóbbi további emésztésével kapható végdarabja, amely a halál domént tartalmazza (LRR: hét tandem leucin gazdag ismétlődés, Zu5: fehérje interakciós domén, CARD: caspase recruitment domain, p20: az aktív kaszpáz nagy alegysége, p10: az aktív kaszpáz kis alegysége, PIDD, RAIDD: l. szövegben)
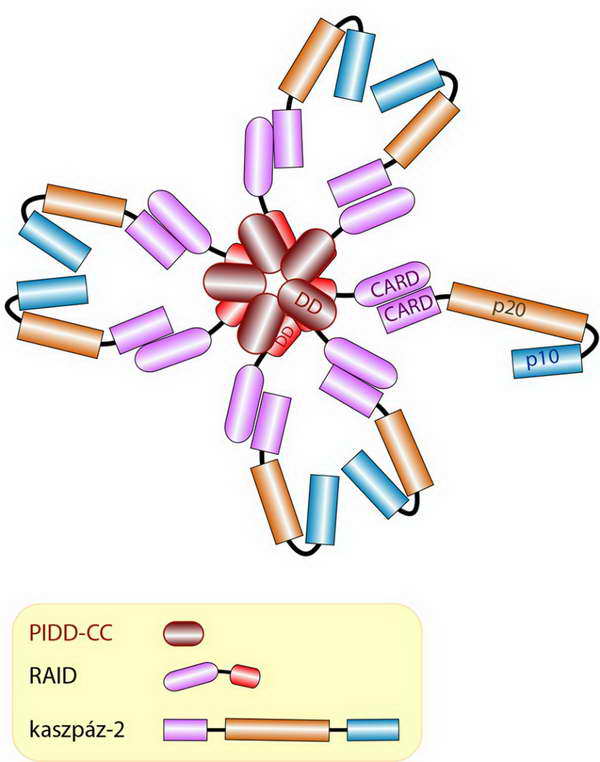
36. ábra. A PIDDoszóma szerkezete: a komplex hét kaszpáz-2 molekulát tartalmaz (a rövidítések jelentését l. a szövegben)
Az aktív kaszpáz-2 közvetlenül részt vesz effektor prokaszpázok (prokaszpáz-3, -6, -7) proteolitikus aktiválásában és/vagy – a kaszpáz-8-hoz hasonlóan – csonkolja a Bid-et, és „felerősíti” a mitokondriális (belső) sejthalál útvonalat (21. és 29. ábra)
Öszefoglalva: a p53 aktivációja esetében nagyon igaz az a mondás, miszerint „minden út Rómába” – azaz a sejt aktív önpusztításához – „vezet” (37. ábra).
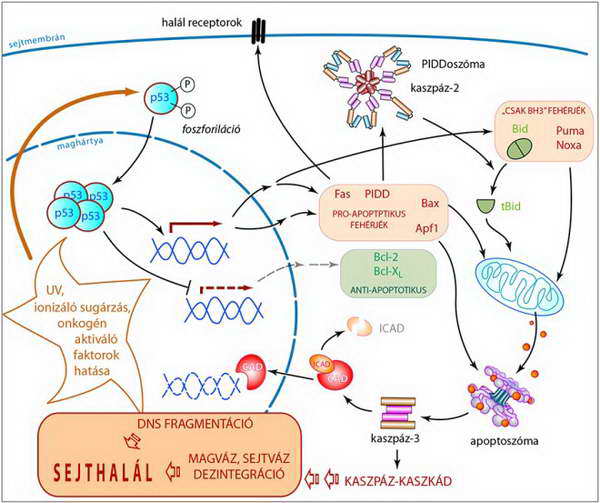
37. ábra. A p53 fehérje központi szerepe az apoptózisban (az ábra csak a legfontosabb útvonalakat mutatja; a részleteket l. a szövegben)
A leírtak alapján nem véletlen, hogy az immortalizált sejtek létrehozásának egy közkedvelt eszköze a p53 gén kiütése (p53 knockout).
Az apoptotikus sejthalál esetében a „sejthullák” eltakarítása csakúgy, mint maga a sejthalál folyamata, szabályozott folyamat. Előkészítését maga a pusztuló sejt kezdeményezi. Az apoptotikus sejt kemotaktikus „találj meg” szignálokat bocsát ki (lizofoszfatidil-kolin, LPC), amelyek fagocitotikus aktivitással rendelkező sejteket (pl. szöveti makrofágok, monociták) vonzanak a közelébe. (38.A ábra). (Ezek hiányában azonban a környező szöveti sejtek is képesek a sejtmaradványok bekebelezésére.)
Az apoptózis egyik korai velejárója, hogy a sejtmembrán külső felszínének molekuláris mintázata megváltozik. Ez a későbbiekben úgynevezett „egyél meg” szignálként szolgál majd. Ennek az apoptotikus membrán-mintázatnak a kialakításában szerepe van egyes fehérjék glikozilációs mintázatváltozásának, eredetileg belső membránrétegben elhelyezkedő membrán komponensek külső rétegben, azaz a sejtfelszínen való megjelenésének (pl. foszfatidil-szerin).
A fenti sejtfelszíni szignálokat a fagocita sejtek specifikus receptorai ismerik fel (pl. foszfatidil-szerin, integrin és intracelluláris adhéziós molekula receptorok, 38.B ábra). A megfelelő receptor-ligandum kötések kialakulása a fagocitáló sejt sejtváz rendszerének átrendeződésével megteremti a lehetőséget a sejtmaradvány és az apoptotikus testek teljes bekebelezésére (38.C ábra). A környező sejtek és az egész szervezet számára rendkívül fontos, hogy sem az apoptotikus sejthalál, sem pedig az ennek végeredményeként megjelenő sejtmaradványok eltakarítása nem vált ki gyulladásos immunreakciót, hiszen a pusztuló sejt citoplazmatikus komponensei mindvégig ép membránnal körülvett térben vannak, s a „temetést végző” fagocitáló sejt gyulladásgátló szignálokat is kibocsát a környezetébe (38.D ábra).
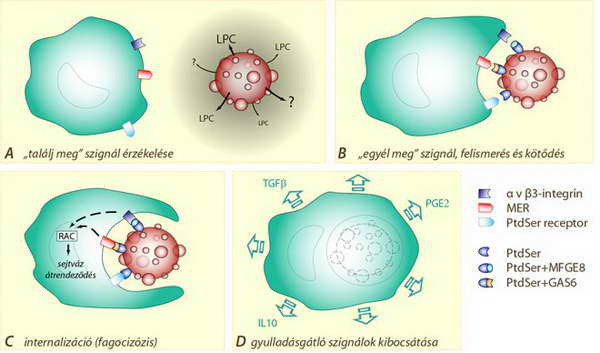
38. ábra. Az apoptotikus „sejthullák” eltakarítása: a pusztuló sejtből olyan szignálok szabadulnak fel (LPC), amelyek a makrofágokat odavonzzák (A). A felismerés és a kötődés megfelelő receptorokon keresztül megtörténik (B), majd a makrofág bekebelezi a sejtmaradványokat (C), s gyulladásgátló jelzéseket (IL10, TGF, PGE2) is küld a környezetébe (D)
A programozott sejthalál apoptotikus típusának morfológiai jellemzői és a változások mögött álló biokémiai történések sorozata, beleértve a molekuláris komponenseket is, azt mutatják, hogy ez a sejtek életében egyedi és megismételhetetlen élettani folyamat az evolúció során rendkívül konzervatív maradt.
Az apoptózissal elhaló sejtek elhatárolódása a környezettől (a sejt-sejt és a sejt-extracelluláris mátrix kapcsolatok megszakadása), amely a legömbölyödéshez vezet, a sejthártya hólyagosodása, a sejt zsugorodása, a citoplazma denzitásának fokozódása, a sejtmag kromatin állományának perifériális kondenzációja, majd a sejtmag fragmentálódása, végül az apoptotikus blebek lefűződése és a sejt membránnal határolt apoptotikus testekbe való teljes szétesése mind-mind megfigyelhetők a legegyszerűbb többsejtű élőlényektől egészen az emlősökig.
Az apoptózisban szerepet játszó gének és géntermékek közül a legelsőket a Caenorhabditis elegans egyedfejlődésének vizsgálata, a sejtsorsok tanulmányozása során fedezték fel. Tehették ezt azért, mert ez a többsejtű élőlény mindössze 1090 sejtből épül fel, amelyből az egyedfejlődése során – időben és térben jól meghatározható módon – aktívan, programozottan 131 sejt pusztul el.
Az első CED-gének (cell death abnormality, CED-9, CED-4, CED-3) leírása után intenzív kutatások kezdődtek és zajlanak napjainkban is az apoptózisban szerepet játszó molekuláris komponensek minél nagyobb számának felderítése, szerepük és működésük megértése céljából. Ezek a vizsgálatok – a két közkedvelt gerinctelen kísérleti modell, a C. elegans és a Drosophila mellett – döntően emlős sejteken zajlanak.
Az alábbi, 38. ábra az apoptózis kivitelezésében kulcs-szerepet játszó fehérje családok egy-egy tagjának evolúciós homológjait mutatja be.

38. ábra. Az apoptózis lebonyolításában résztvevő molekula családok konzervativizmusa
Terjedelmi korlátok miatt ebben a fejezetben csak egy összefoglaló, áttekintő képet adhattunk az apoptózis molekuláris sejtbiológiai mechanizmusairól és a folyamat szabályozásáról. Ebből is jól látszik azonban, hogy a sejt „öngyilkos akciója” milyen rendkívül finoman összehangolt jelátviteli útvonalak együttműködése révén vezet el a végkifejlethez, a sejt halálához.