A külvilág számunkra fontos mechanikai információit mechanoszenzoros sejtjeink közvetítik a központi idegrendszerbe, ezáltal leszünk képesek elhelyezni magunkat a minket körülvevő világban. Ezt a folyamatot nevezzük szervezetszintű mechanotranszdukciónak. Az ezt végző sok különböző mechanoszenzoros sejt (proprioceptorok, mechanoreceptorok, szőrsejtek stb.) szignál transzdukciós sémája tulajdonképpen nagyon hasonló.
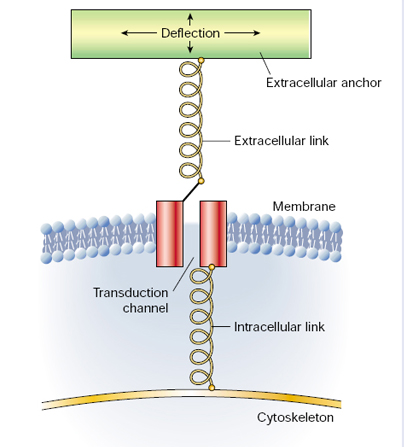
1. ábra A mechanoszenzoros transzdukció általános sémája. Gillespie, P. G. and R. G. Walker (2001). "Molecular basis of mechanosensory transduction." Nature 413(6852): 194-202.
A hangsúlyt a sejtek minden esetben a sebességre és a szenzitivitásra helyezik. A folyamat kulcseleme a mechanikai inger egyetlen, mechanoszenzitív ioncsatornára történő irányítása. Ezt a feladatot az extracelluláris tér kapcsolómolekulái végzik. Az ioncsatorna kapuzó stratégiája megváltozik, amelynek tényét az intracelluláris kapcsoló fehérjék közvetítik a citoszkeletális elemekhez, minek következtében kialakul az akciós potenciál. Meg kell jegyeznünk, hogy ez a szignál transzdukció rendkívül gyors, így second messengerekre sincs szükség. Az előbb vázolt séma nem csupán a külvilág mechanikai információinak „beszállítóira”, az ún. professzionális mechanoszenzoros sejtekre érvényes. Megfigyelhető a szervezet minden sejtjénél a közvetlen mikrokörnyezet érzékelése során. Ez utóbbi jelenséget nevezhetjük sejtszintű mechanotranszdukciónak. Ebben az esetben természetesen nem az akciós potenciál kiváltása a cél, hanem egy lokális sejtválasz, alakváltozás alakul ki. A valóságban számos összetevő koordinált munkája teszi lehetővé a sejtszintű mechanotranszdukciót. A jövőbeli kutatások célja, hogy a már ismert mediátorok.
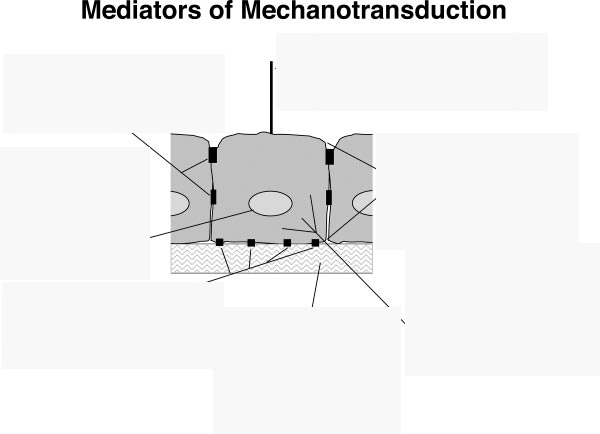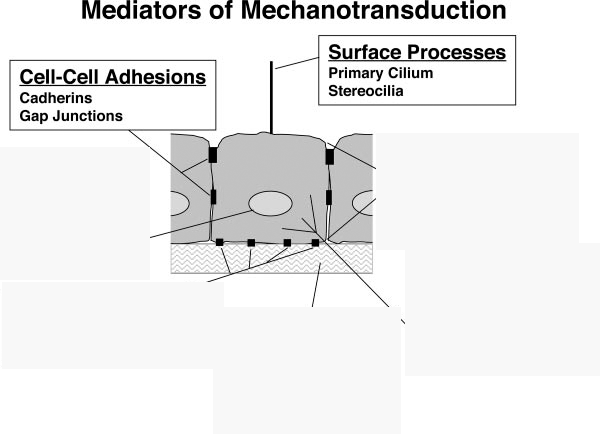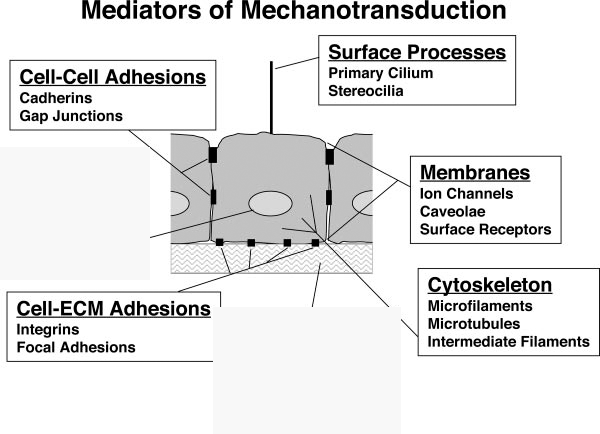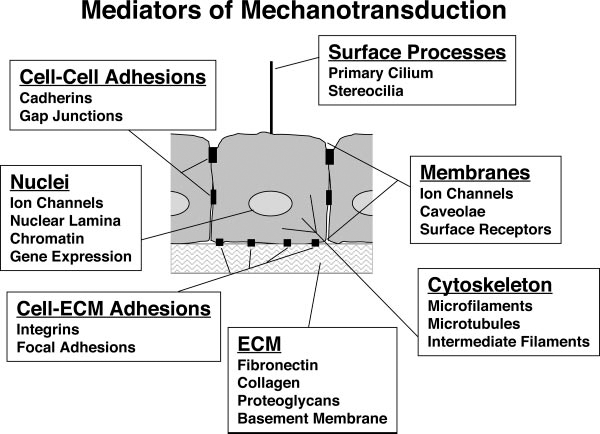
2. ábra A celluláris mechanotranszdukció mediátorai. Ingber, D. E. (2006). "Cellular mechanotransduction: putting all the pieces together again." Faseb J 20(7): 811-27.
közti arányokat, interakciókat és a pontos szabályzó mechanizmusokat tisztázzák.
A sejtmembrán dinamikája, illetve annak bármilyen kismértékű megváltozása fontos szignálja lehet a mechanotranszdukciónak. Az eddigi biológiatanulmányok során számtalan alkalommal beszéltünk a membránfehérjékről, azok funkcióiról, vagy az exo-endocitózis lépéseiről. Arról azonban nem tettünk említést, hogy pl. egy fehérje érkezése vagy távozása befolyásolja a membrándinamikát. A membrán torziói pedig megváltoztatják a benne található proteinek konformációját és ezáltal funkciójukat is. A membrán képes alkalmazkodni a beépülő fehérjék szerkezeti eltéréseihez a hidrofób régióinak alakváltozásaival (elhajlás, nyújtás stb.). Ennek hiányában a fehérje hidrofób részei vizes közegbe kerülnének, amelynek fenntartása nagy energia befektetéssel járna a sejt számára, nem beszélve az instabil szerkezet veszélyeiről. Ezt a folyamatot hívjuk hidrofób match-nek, amelynek célja a membrán felszínén a mechanikai nyíróerő csökkentése a „kilógó” fehérjerészek minimalizálásával.
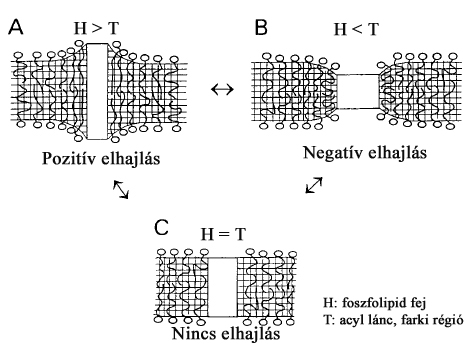
3. ábra Membrándinamika és protein inszerció. Hamill, O. P. and B. Martinac (2001). "Molecular basis of mechanotransduction in living cells." Physiol Rev 81(2): 685-740.
A hidrofób mismatch definíciója pedig az adott protein membránból való kiemelkedését jelzi.
Tekintettel a mechanoszenzáció fontosságára, sok vizsgálatnak célja a folyamatok alapjának tisztázása és a finomregulációs kölcsönhatások feltárása. A mechanoszenzációt egyaránt lehet a szervezet szintjén (behavioral assay) és a sejt szintjén (cell- based assay) vizsgálni. A 4. ábra összefoglalja a legelterjedtebb teszteket.
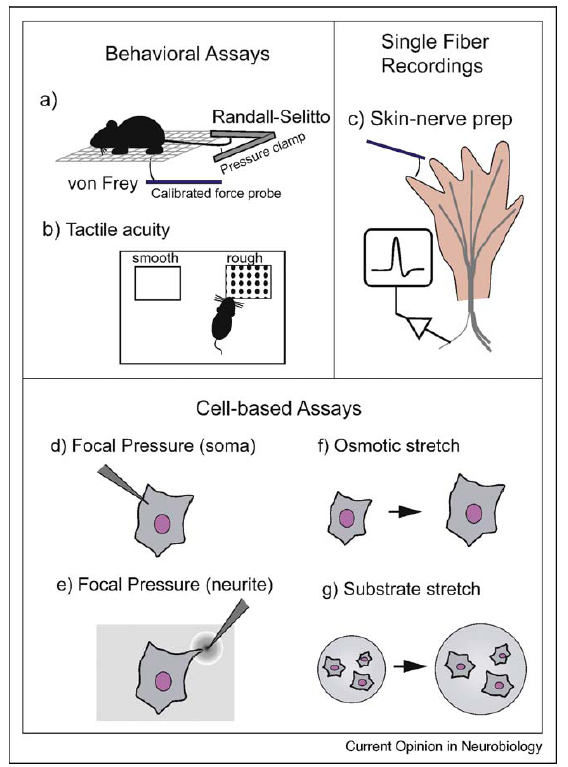
4. ábra Mechanoszenzáció sejt- és viselkedésszintű vizsgálatai. Tsunozaki, M. and D. M. Bautista (2009). "Mammalian somatosensory mechanotransduction." Curr Opin Neurobiol 19(4): 362-9.
Szervezet szintjén az állat láb-elrántási reflexét a von Frey teszttel mérhetjük, amelynél kalibrált poliészter szálakat érintenek az állat bőréhez. A mechanikai ingerre adott reakciókat statisztikailag értékelve vonhatunk le az állat mechanoszenzációjával kapcsolatos következtetéseket. A Randall-Selitto teszt esetén computerrel összekapcsolt rendszer detektálja az előbbinél erősebb fájdalmas mechanikai stiumulus által kiváltott elrántási reflexet. A taktilis ügyesség teszt során az állat különböző textúrákkal találkozik, és az egyes felszínek megismeréséhez szükséges időt mérhetjük. Az egy-rost elvezetéses vizsgálatok a környező idegektől izolált axon vezetési sebességének és a hozzá tartozó bőrszelvény ingerelhetőségének mérését teszik lehetővé. A sejtszintű mérések elsősorban a szómát és /vagy axont ért pontszerű mechanikai behatások következményeire koncentrálnak. A sejteket hipoozmotikus oldatba helyezve sejtduzzadást figyelhetünk meg, amely jelentős mechanikai stressz tényező. A nyomás, nyújtás, nyíróerő változás, ozmotikus behatás mind membrán deformáción alapulnak, de eltérő MS ioncsatorna populációt aktiválnak. A MS ioncsatornák in vitro tesztelésére számos stimulust alkalmazhatunk.
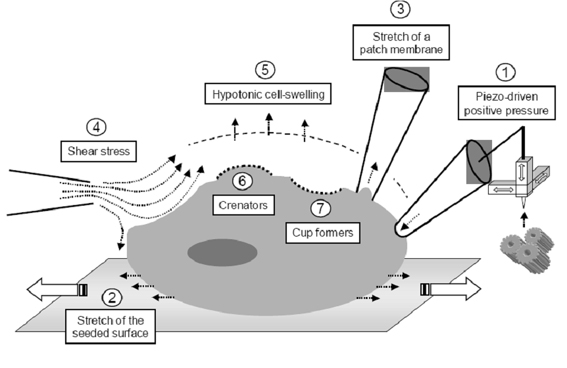
5. ábra Mechanoszenzor ioncsatornák in vitro vizsgálati módszerei. Kamkin, A. (2008). Mechanosensitivity of the nervous system. New York, Springer, p 53.
Az elektromos töltések felhalmozódásából származó pozitív nyomás alkalmazásakor jól analizálható MS ionáramokat regisztrálhatunk. Az ezzel ellentétes irányú negatív nyomás esetén (szívóerő) más ioncsatorna populációk aktivitása mutatható ki. Ismerünk olyan ioncsatornákat, amelyek kizárólag a foszfolipid bilayer nyújtásakor lépnek működésbe. A sejttenyészetben végzett kísérleteknél egyszerű tesztelési módszer lehet a tenyészet alapját képező szubsztrát elmozdítása. A szuperfúziós oldat fizikai paramétereinek megváltoztatása (áramlási sebesség, viszkozitás stb.) a sejtmembránt érő nyíróerő hatékony modellje lehet. In vivo különösen fontos lehet ez a típusú mechanikai stressz az egyes ér endothel és vese sejtek életében. A plazmamembránba ékelődő különböző töltésű molekulák is megváltoztatják a félfolyékony hártya mechanikai paramétereit. A pozitív töltéssel rendelkező amfipatikus molekulák (tetracain, klór-promazin) a belső membránfélbe inszertálódnak, így azt intracellulárisan deformálják, mintegy csésze alakot képezve (cup formers). Ugyanakkor a negatív töltésű molekulák (szabad zsírsav, trinitrofenol) a külső membránféllel lépnek kölcsönhatásba, extracelluláris irányba „húzva” a membránt; őket nevezzük csipke képzőknek (crenators).
A sejtek egymás közelségét, a szöveti citoarchitektúra megváltozását alapvetően a sejtmembránjaikon keresztül érzékelik. Az integrin alapú fokális adhéziók vizsgálata során megérthetjük, hogyan képesek a sejtek egymás közelségének detektálására, vagy akár diffúz, pontszerű kapcsolatok pontos felismerésére is.
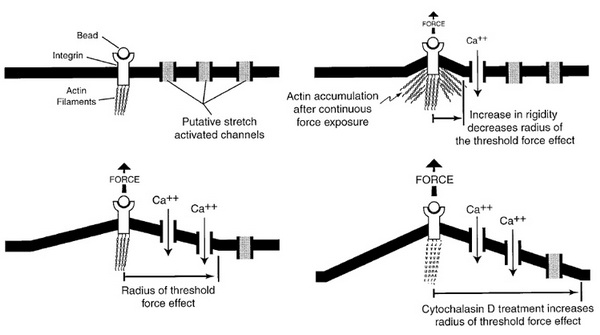
6. ábra Integrin alapú fokális adhéziók vizsgálata. Janmey, P. A. (1998). "The cytoskeleton and cell signaling: component localization and mechanical coupling." Physiol Rev 78(3): 763-81.
A modellkísérletben az integrinhez kötődő extracelluláris ligand szükséges feltétele az adhéziónak, de nem elégséges a plazmamembrán és CSK közti kapcsolat átalakításához, szignalizáció beindításához. Az ábrán elsősorban a z integrinhez kapcsolódó aktin citoszkeletont ábrázolták, de természetesen a citoszkeleton többi eleme is részt vesz a folyamatban. A mechanotranszdukció elindításához még egy paraméternek jelen kell lennie: a mechanikai erőbehatás (tenzió, nyíróerő stb.) Az integrin receptor környezetében található nyújtás aktivált ioncsatornák alaphelyzetben zárt állapotban vannak. Az aktin citoszkeleton átrendeződése (az integrinre gyakorolt mechanikai erőbehatás eredményeként) azonban kinyitja a csatornákat. Az aktin átrendeződése specifikusan csak a stimulus behatási pontján indul meg és arányos az alkalmazott mechanikai erő nagyságával. Minél nagyobb a mechanikai hatás (erősebb kapcsolódás) annál nagyobb mértékű a citoszkeletális átrendeződés (aktin aggregáció). A citoszkeletális rigiditás emelkedése pedig csökkenti a stimulus aktivációs sugarát (vagyis az egy ponton ható mechanikai stimulus által nyitott ioncsatornák számát). Ebből kifolyólag, minél erősebben kapcsolódik a sejt valamely extracelluláris elemhez, vagy másik sejthez, annál kevesebb (és a stimulushoz közelebbi) ioncsatorna lép működésbe, azaz a sejt képes „ráfókuszálni” a behatás pontos helyére. Amennyiben az aggregált aktin filamentumokat pl. CytochalasinB-vel bontjuk, több ioncsatornára terjed ki az aktiváció, aspecifikussá válik a felismerés, nem alakul ki a fokális adhézió.
A mechanikai stresszre alapvetően három szinten kaphatunk válaszokat. A szervezet strukturális felépítésében bekövetkezett ún. makro-változásokat a kötőszövet és az ECM mechanikai torziói követik (mikro-változások), ez utóbbiak pedig a sejten belül váltják ki a CSK és a nucleus szintjén elemezhető nano-változásokat. A 7. ábra egy hipotetikus szöveti elrendeződést mutat be, ahol a kötőszövet kollagén rostjainak (csíkozott sávok) orientációja a tenzió hatására megváltozik. A kollagén rostokkal kapcsolatban álló a fibroblasztok sejtmagjában és CSK-jában (piros vonalak) is detektálhatók a strukturális változások.
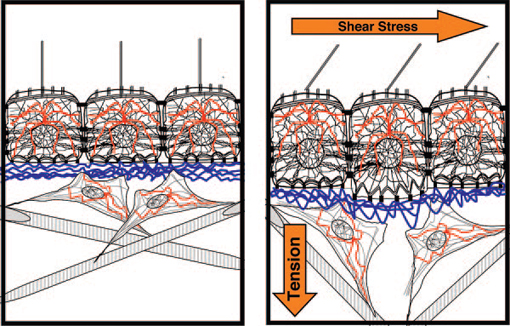
7. ábra Extracelluláris mátrix, citoszkeleton és mechanoszenzáció. Ingber, D. E. (2006). "Cellular mechanotransduction: putting all the pieces together again." Faseb J 20(7): 811-27.
A bazális membrán (hullámos kék vonal) kapcsolja a kötőszövetet a hámréteghez, így az egyik réteg szerkezeti változásai nem hagyhatják érintetlenül a hozzá kapcsolódó egyéb szövetréteget sem, következésképp az endothel sejtek rétegében is megfigyelhetők a CSK és nucleus változásai. Ugyanakkor a nyíróerőben bekövetkezett változások elsősorban az apikális plazmamembrán nyújtását váltják ki. A CSK közvetítő szerepe miatt azonban a sejtek bazális pólusa (bazális membrán és a kötőszövet is) is érintetté válik.
A sejtalak változásának kontrollja a CSK és ECM közti egyensúlyon múlik.
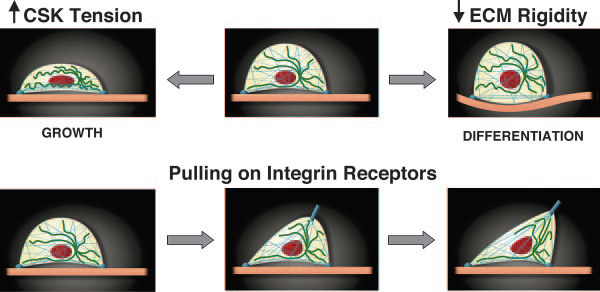
8. ábra Sejtmorfológia változása és a mechanoszenzáció kapcsolata. Ingber, D. E. (2006). "Cellular mechanotransduction: putting all the pieces together again." Faseb J 20(7): 811-27.
A sejt ciklus progressziójához egy rigid ECM-re van szükség. Amennyiben ilyenkor még a sejt CSK tenzioja is emelkedik, a sejt bazális pólusán stressz-rostok képződnek (Aggregált aktin filmanetumok) és a mikrotubulus polimerizáció is felgyorsul, a sejt ellapul. Ha azonban az ECM rigiditása annyira lecsökken, hogy nem tud ellenállni a CSK húzó erejének, akkor a sejt gömb alakot vesz fel. Utóbbi állapot alapfeltétele a differenciálódásnak.
A sejtalak, citoszkeleton és a génexpresszió kapcsolatát elemzi a 9. ábra.
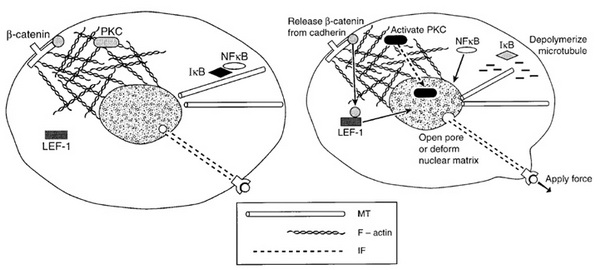
9. ábra Citoszkeleton és sejtmagi szignalizáció. Janmey, P. A. (1998). "The cytoskeleton and cell signaling: component localization and mechanical coupling." Physiol Rev 78(3): 763-81.
Az intermedier filamentumok (IF) direkt mechanoszenzációban betöltött szerepe viszonylag régóta ismert. Az IF rendelkezik specifikus histon- és lipidkötő doménnel is. Ha a citoszkeleton másik két fő alkotóját (aktin, mikrotubulus) destabilizáljuk, a nucleusban akkor is kimutathatók mechanikai stimulusra aktiválódó génexpressziós változások. Intakt aktin hálózat elengedhetetlen a PKC nukleáris importjához (kináz szerep, szignalizáció). A sejt-sejt kontaktusok jelző molekuláihoz (cadherin) kapcsolódik a béta catetin. Mechanikai ingerre disszociál cadherinről és a limfoid enhancer-binding factorhoz (LEF) köt. Az így kialakult komplex már a sejtmagban expressziós változásokat indukál. Az eddigi esetekben a magtranszporthoz a célfehérje módosítására volt szükség. A citoplazmatikus nfkB transzkripciós faktor az inhibitoros ko-faktora által blokkolt állapotban van. Ez utóbbi a mikrotubulusokhoz kötött, így azok depolimerizációjakor ledisszociál az nfkB-ról, megengedve annak magi transzportját és a génexpressziós változásokat.
Mindezeket a változásokat a sejtmembránban található MS ioncsatornák aktivitása indítja el. Akárcsak a feszültségfüggő vagy a receptor mediált ioncsatorna családokat, a MS ioncsatornákat is fel lehet osztani ionszelektivitás, vezetés és farmakológia tulajdonságok alapján. Esetünkben legjelentősebb a mechanikai stimulusra adott válaszuk alapján történő kategorizálásuk (10. ábra).
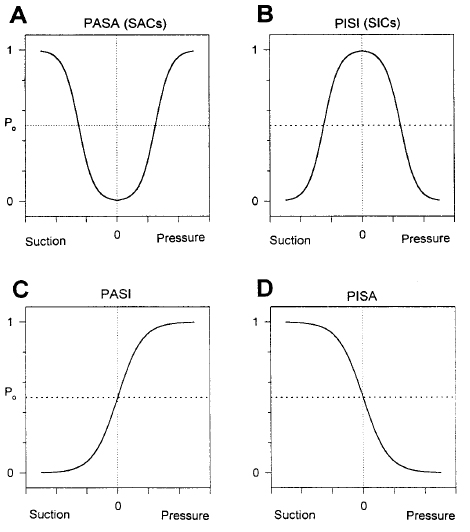
10. ábra Mechanoszenzitív ioncsatornák tulajdonságai. Hamill, O. P. and B. Martinac (2001). "Molecular basis of mechanotransduction in living cells." Physiol Rev 81(2): 685-740.
A nyújtásra kinyíló ioncsatornakát SAC (stretch activated channel), míg a záródókat SIC (stretch inactivated channel) rövidítéssel illetjük. A különböző csatornák eltérő karakterisztikát (A: aktiváció, I: inaktiváció) mutatnak a pozitív nyomásra (P, pressure) és a negatív szívóerőre (S, suction). Ez alapján megkülönböztetünk szimmetrikus és asszimetrikus csatornákat.
A sejtek a mechanikai ingerekre sokféle válaszrekcióval reagálhatnak. A legfontosabbak közül említünk meg néhányat. A tenzió szenzitív vezikuláció/exocitózis során a nagy membrántenzió gátolja a membrán betűrődését, de ugyanakkor serkenti a már meglévő vezikulák fúzióját (a vezikula inszerció ugyanis csökkenti a membrán felületi feszültséget. A membrán nyújtása serkenti tehát az exocitózis mértékét. Meg kell jegyeznünk, hogy ez nem minden sejt esetén univerzális válasz. A specializált masztocitáknál a sejttérfogat négyszeresre duzzadása reverzibilis exocitózis blokkal jár (elkerülendő a felesleges degranulációt). A membrán-dugó a legprimitivebb formája a membránsérülésre adott válaszoknak. A sérülést követő Ca2+ emelkedés hatására vezikula szintézis és fúzió zajlik a sérül t membrán közelében, majd a fúzionált vezikulák a folytonossági hiányt pontosan kitöltik a sérült pontra történő transzlokációt követően. Magas Ca2+ koncentrációt és calpain aktivációt igényel, relatív lassú folyamat (percek-órák). Ezzel szemben az exocitózis modell, másodpercek alatt végbemenő gyors folyamat, amely során a sérülés helyén egyszerűen megemelkedik a már készen álló vezikulák exocitózisa. Tulajdonképpen csupán a vezikulák plazmamembránba történő inszerciójának frekvenciáját emeli meg a sejt.
Az ezrin-radixin-moesin (ERM) fehérjék a citokortex strukturális komponensei, a membrán – citoszkeleton – citoplazma specifikus kapcsolói. Számos feladtuk közé sorolhatjuk a sejt és az ECM kontaktpontjainak meghatározását, vezikulák célzott transzportját, receptor csoportok kialakítását. Expressziójuk in vivo szövet, sejt és polaritás specifikus. Ezrin az apikális pólus meghatározásának egyik fő komponense. A sejt differenciálódása során még basolaterálisan lokalizálható, de az érett sejtben transzlokálódik az apikális membrán területére. Ezrint az intsztinális kefeszegély mikrovillusaiból izolálták először, az epidermális növekedési faktor szubsztrátja. A moesin limfoid és endothel sejtek heparin kötő fehérjéje, míg a radixin egy f-aktin sapka fehérje, máj dezmoszómákból. Együtt tárgyalásukat a rendkívül hasonló doménszerkezet
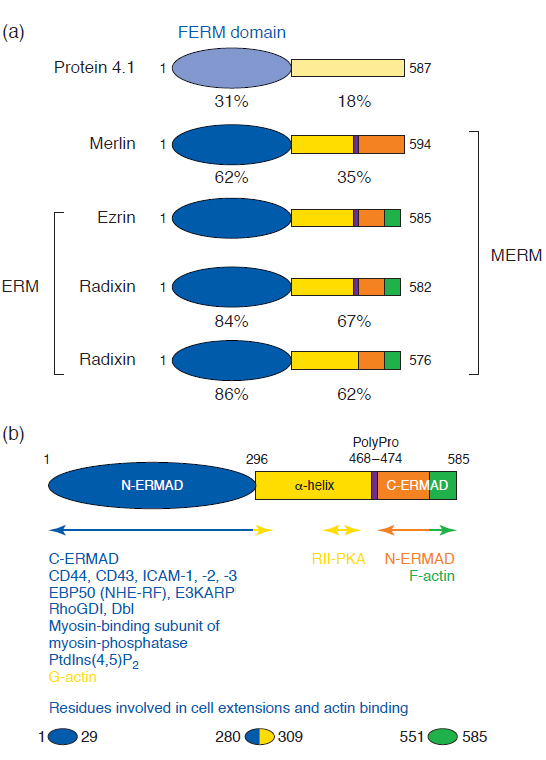
11. ábra Az ERM doménszerkezete. Mangeat, P., C. Roy, et al. (1999). "ERM proteins in cell adhesion and membrane dynamics." Trends Cell Biol 9(5): 187-92
és a funkció indokolja. Az ábráról leolvasható az N-és C-terminális asszociált domén (N-ERMAD, C-ERMAD) és a köztük található alfa hélix szerkezete, a hozzájuk kötődő interakciós parnerek, amelyek színkódjai megeygeznek a kötött domán régió színeivel. Az N-ERMAD végzi a plazmamembrán kötését, míg a C-ERMAD a citoszkeleton (aktin) kötésben játszik szerepet. Az alfa hélix domén a dimerizációt és más ERM tagokkal való kapcsolódást segíti. Alap állapotban a fehérje nem teljes hosszúságú, hanem feltekeredett konformációban található. PKC téta és Rho kináz által végzett foszforiláció szükséges az önasszociált forma kitekeredéséhez, ezáltal az aktív forma kialakulásához.
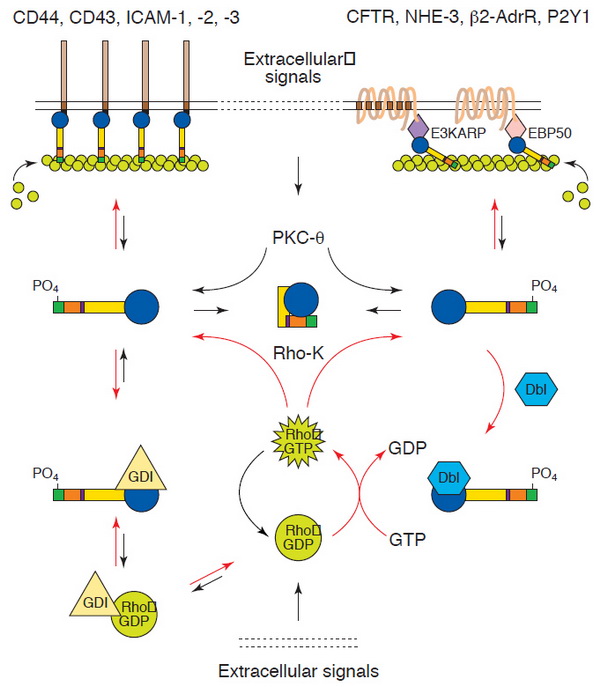
12. ábra Az ERM konformációja és az aktivációs mechanizmus. Mangeat, P., C. Roy, et al. (1999). "ERM proteins in cell adhesion and membrane dynamics." Trends Cell Biol 9(5): 187-92
Az ily módon kitekert molekula már képes a plazmamebránhoz kötnid direkt (pl. CD44 receptorhoz) vagy indirekt (pl. béta adrenerg receptorhoz) módon. Az ERM családba tartozó tumor szupresszor protein a MERLIN (moesin-ezrin-radixin like protein). Funkciója a kontaktgátlás és más tumor szupressziós útvonal aktiválása, illetve receptor endocitózis indukciója. Fontos megjegyeznünk, hogy a MERLIN a többi tumor szupresszortól eltérően nem rendelkezik sem katalitikus sem DNS kötő doménnel. Az ERM-el szerkezetileg nagy homológiát mutat, de aktivációs mechanizmusában eltér azokétól.
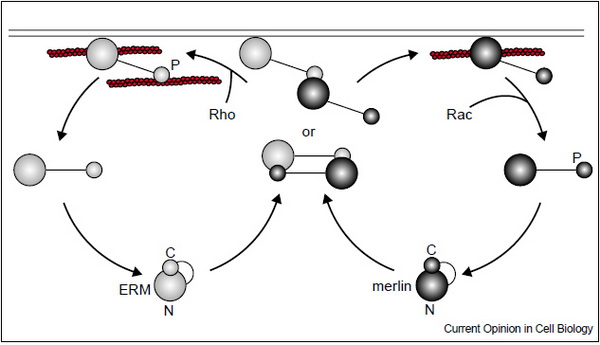
13. ábra Az ERM és a MERLIN aktivációjának összehasonlítása. Gautreau, A., D. Louvard, et al. (2002). "ERM proteins and NF2 tumor suppressor: the Yin and Yang of cortical actin organization and cell growth signaling." Curr Opin Cell Biol 14(1): 104-9.
A C-terminálison egy Rac-GTPáz mediált szerin foszforiláció a fehérje nyílt konformációt vesz fel és nem köt aktinhoz, inaktivált állapotba kerül. Asejt-sejt adhézió szabályozza a Merlin mennyiségét és foszforiláltsági állapotát. A nem foszforilált (azaz aktív!) Merlin kontaktgátlást vált ki CD44 hialuronsav receptoron keresztül. A foszforiláció csökkenti az önasszociált forma életképességét, inaktivizálódik a fehérje és ledisszociál a citoszkeletonról. Az ERM és a MERLIN tulajdonképpen a sejtosztódás két ellentétes regulátorának is tekinthető, hiszen az ERM (főként az ezrin) növeli a sejtosztódás valószínűségét, míg a Merlin gátolja azt.
A Merlin extracelluláris információkat integrál különböző adhéziós receptorokból.
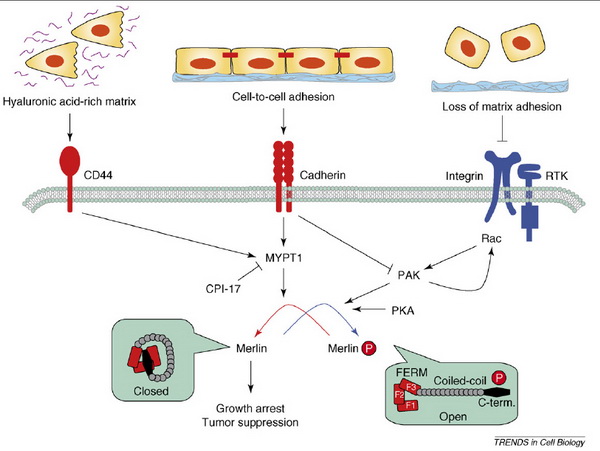
14. ábra MERLIN: szignalizáció és funkció. Okada, T., L. You, et al. (2007). "Shedding light on Merlin's wizardry." Trends Cell Biol 17(5): 222-9.
Ezek aktiválják a miozin foszfatázt (MYPT1), amely defoszforilálja Merlin C-terminális szerinjét, kialakítva ezzel a zárt, aktív konformációt. Ez a forma asszociál CD44-el és cadherinnel, sejtciklus blokkot és tumor szupressziót indukál. Az integrin receptor tirozin kináz (RTK) komplex PAK (p21 aktivált kináz) aktivációt indít, növekedik a foszforilált (inaktív) Merlin forma mennyisége, sejtciklus beindul. PAK a RAC kinázt az integrinekhez irányítja, bekövetkezik a szignálamplifikáció. Emellett aktiválja a CPI17-et (PKC potenciált foszfatáz inhibitor), amely legátolja a miozin foszfatázt. Ez szintén a foszforilált inaktiv Merlin koncentrációt növeli.
A Merlin a sejtkapcsolatokat stabilizálja, sejtfelszíni receptorok internalizációjával csökkenti a szignalizációt, illetve más tumor szupresszor utak aktivációjában működik közre.
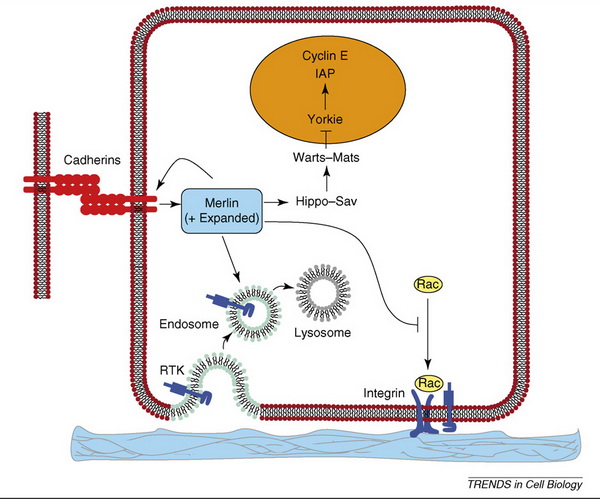
15. ábra A MERLIN sejtproliferációra gyakorolt hatása. Okada, T., L. You, et al. (2007). "Shedding light on Merlin's wizardry." Trends Cell Biol 17(5): 222-9.
Rac szignalizáció gátlásával stabilizálja a cadherineket, így alakítja ki a stabil sejtkapcsolatokat. A Hippo útvonal fejlődő epitheliumban limitálja a proliferációt, ennek inaktiválása tumor kialakulásához vezethet. Merlin elemei a Hippo útvonal hatékonyságát drosophilában, blokkolja Cyclin E aktivitását. Invazív fenotípus elérésekor a sejtek elvesztik a sejtkontaktust, motilissá válnak, membránhullámosodás, lamellipodiumok kialakulása jellemző. Ezek mind a Rac szignalizáció következményei és ennek gátlásával a Merlin idő és energiatakarékos módon váltja ki tumor szupresszor hatását.
Az ERM család szerepet játszik a sejtfelszíni receptorok lokalizációjának szabályozásában is. A plazmamembrán receptorok expressziója és eloszlása szigorúan koreográfia szerint, szabályozott módon zajlik. Az extracelluláris mátrix felől érkező fizikiai stimulus képes szignifikánsan befolyásolni a receptorok eloszlását és ebből adódóan a szignál transzdukciót is. A lokális citoszkeleton (ankirin, spektrin, filamin) szerepe is jelentős. A vörösvértest membránja szorosan kapcsolódik az ankirin, spektrin tartalmú kortikális citoszkeletonhoz. A specifikus sejt-sejt kontaktus pontjain a kortikális aktin gyűrű stabilizálásához pedig a MERLIN jelenléte szükséges. Az ERM család tagjai a stabilizátor funkción túl, receptor eloszlás befolyásoló szerepkörrel is rendelkeznek. Az ezrin fehérje hiánya egérben az epithel sejtek kefeszegély dezorganizációját és a plazmamembránban található NHE-RF (Na/proton cserélő regulációs faktor) diszlokációját eredményezi. A keringő T limfociták membránjának felszíne mikrofoldingokkal tűzdelt. A kemokinek aktivációja ERM inkaktivitást indít el, amely a limfocita membránjának kisimulásával jár. Ezzel párhuzamosan megváltozik az adhéziós receptorok eloszlási mintázata is, amely végül az endothel sejt receptoraival történő asszociációhoz vezet és az extravazáció (szöveti migráció) molekuláris alapját képezi. Az antigén prezentáló sejt (APC) hatására kevesebb, mint egy perc alatt megtörténik a T sejt receptor (TCR) aktiválása. Ezidő alatt leépül az ERM rendszer (a folyamat természetesen reverzibilis), kisímulnak a felszínnövelő struktúrák a plazmamembránon és létrejön az immunológiai szinapszis (szoros kapcsolat az APC és a T limfocita közt). A kontaktusfüggő komplexképződés (értsd: E-cadherin + Merlin + EGF receptor) egy in vitro megfigyelt folyamat, amelynek lényege, hogy a sejt-sejt kontaktus pontjain (és csak ott!) a Merlin az EGF receptort szeparálja egy olyan membrán szegmentumba, amely nem kerül internalizálásra ugyanakkor gátolja a receptorhoz való hozzáférést. A reakcióhoz szükséges az E cadherin jelenléte és a NHE-RF kapcsolódása is. In vivo ugyanez az EGF blokkolás gyorsabban zajlik, ugyanis a Merlin a növekedési faktor receptorát egyszerűen eltávolítja a membránból, így gátolva meg a receptorhoz való hozzáférést, következésképp blokkolva a szignalizációt.
A mechanoszenzáció, a mechanikai kontaktus és a mechanikai változásokból adódó stressz minden sejt életének fontos tényezői. Elmondhatjuk, hogy a plazmamembrán az eddig jól ismert funkcióin túl mélyreható szerepet játszik a sejtek mechanikai stressz toleranciájában és ezáltal a mindennapi funkciójuk biztosításában.
16. ábra