A permeábilis ionok, illetve az impermeábilis proteinek és nukleinsavak aszimmetrikus eloszlása által fenntartott ozmotikus hajtóerő egy ún. „steady-state” egyensúlyt határoz meg. A sejt folyamatosan, alacsony energia bevitellel tartja fönn ezt az optimális állapotot („setpoint”). Amennyiben az aktuális setpoint értéktől pozitív/negatív irányba eltérést érzékel, a sejt aktiválja az akut változások korrekciójára alkalmas transzportfolyamatokat. Ezeket összefoglaló néven szabályozott térfogat növelésnek és csökkentésnek (regulatory volume increase/decrease, RVI/RVD,) nevezzük. Az RVI és RVD (1. ábra) tehát nem aktív a steady-state állapotában, így helytelen a sokszor használt definíció, miszerint a steady-state állapot az RVI és RVD eredője lenne. A fenti megoldás a sejt számára energetikailag sokkal kedvezőbb megoldás, mint a két ellentétes hatású térfogat szabályzó mechanizmus állandó működtetése.

1. ábra Az RVI és RVD lépései.. NKCC1: Natrium-kálium-2 klorid kotranszporter, KCC3: Kálium-klorid kotranszporter Kahle, K. T., K. J. Staley, et al. (2008). "Roles of the cation-chloride cotransporters in neurological disease." Nat Clin Pract Neurol 4(9): 490-503..
tehát nem aktív a steady-state állapotában, így helytelen a sokszor használt definíció, miszerint a steady-state állapot az RVI és RVD eredője lenne. A fenti megoldás a sejt számára energetikailag sokkal kedvezőbb megoldás, mint a két ellentétes hatású térfogat szabályzó mechanizmus állandó működtetése.
Az RVI és RVD gyors folyamatok (másodperces, perces nagyságrend), mert az ioncsatornák állandóan a membránban, vagy ún. szubmembrán kompartmentekben találhatóak. Az iontranszportok egy része természetesen nem csupán a térfogatváltozásban vesz részt, hanem számos más sejtválaszban is, mint pl. a pH finomhangolás.
A sejtek hipotóniás extracelluláris környezetben a vízbeáramlás miatt kezdeti térfogat növekedésen (sejtduzzadás) mennek át, majd az RVD során eredeti méretüket visszanyerik. Az RVD fő effektorai a kálium és anion csatornák.

2. ábra Az RVI és RVD effektorai. HICC: hipertonicitás indukált kation csatorna, AE: anion cserélő, NHE1: Na+/H+ cserélő Hoffmann, E. K., I. H. Lambert, et al. (2009). "Physiology of cell volume regulation in vertebrates." Physiol Rev 89(1): 193-277.
A kálium csatornák elsősorban nagy vezetőképességű, Ca2+-aktivált csatornák (ún. BK csatorna). Az anion csatornák konduktanciájának pontos molekuláris folyamata nem ismert ugyan, de valószínűsíthető, hogy a Cl- ionon kívül számos más organikus anion is szerepet játszik benne. Innen származik az ioncsatorna család gyűjtőneve: volume sensitive organic anion channel (VSOAC). Az RVD másik jól ismert transzportere a K+, Cl- kotranszporter (KCC), amely a jelzett ionokat sztöchiometrikusan a membránon keresztül mindkét irányban képes átengedni. Az RVD aktiválásához jelen kutatások alapján, a membránon generált Ca2+ áram (ICa) szükséges. A sejt duzzadása Ca2+ influxot generál a nyújtás aktivált csatornák közreműködésével (SAC, lásd sejtszintű mechanoszenzáció fejezete). Az így megemelkedett intracelluláris Ca2+ koncentráció aktiválja a BK csatornákat.
Az RVI effektorai közé sorolhatjuk az elektroneutrális transzportereket, mint pl. a Na+-K+-2 Cl- kotranszportert (NKCC1) és a Na+/H+ cserélőt (NHE1). Az NHE1 a Cl-/HCO3- cserélővel szinkronban dolgozik. A kialakult kombinált transzport tehát: Na+ és Cl- influx, illetve H+ és HCO3- efflux. Utóbbiak CO2 képződésben vesznek részt, amely a sejtbe visszajutva H+ és HCO3- regenerálását végzi el. Az RVI további szükséges résztvevője a Na+/K+ pumpa, amely a Na+ -ot K+ -ra cseréli le és a termodinamikai energiát szolgáltatja. A folyamat nettó eredménye NaCl influx (2. és 4. ábra).

4. ábra RVI transzportereinek sémája.. O'Neill, W. C. (1999). "Physiological significance of volume-regulatory transporters." Am J Physiol 276(5 Pt 1): C995-C1011.
Néhány sejtben RVI csak RVD után figyelhető meg, mint korrekciós folyamat (RVI – after – RVD jelenség). Az Ehrlich ascites tumorsejtek (EAT) esetében egy ilyen tipikus jelenséget mutat be a 3. ábra.

3. ábra Az RVI és RVD összehasonlítása EAT (Ehrlich ascites tumor) sejtekben. . Hoffmann, E. K., I. H. Lambert, et al. (2009). "Physiology of cell volume regulation in vertebrates." Physiol Rev 89(1): 193-277.
Az EAT sejtekről készült scanning elektronmikroszkópos felvételeket elemezve megállapítható, hogy a sejttérfogat kezdeti növekedése, majd csökkenése a plazmamembrán felszíni képleteinek változásával jár együtt. Az extracelluláris folyadék ozmolaritásának duplájára emelése a sejtfelszíni képletek, plazmamembrán kifeszülésével tolerálható volt a sejt számára, ugyanakkor ennél nagyobb mértékű duzzadás már az előbbieken túl, endomembránok inszercióját igényli. Az extrém körülmények közt élő sejtek nagy ozmotikus toleranciával rendelkeznek (pl. petesejt, mechanoszenzoros neuronok), ezek eredeti méretük többszörösére is képesek növekedni, minden káros következmény nélkül. Ehhez felszínükön nagy mennyiségű membránfelesleget, felületnövelő struktúrákat hordoznak.
A sejtek nem csupán a térfogat változás tényét, hanem annak pontos mértékét, természetét és kinetikáját is felismerik és adekvát válaszreakciót generálnak. A sokféle válaszreakciót összefoglaló néven hiperozmotikus stressz válasznak nevezzük. Ennek során a sejtek érzékelik, elemzik a változásokat, majd azonnali válaszokat, rövid- és hosszú távú adaptációs mechanizmusokat kapcsolnak be.
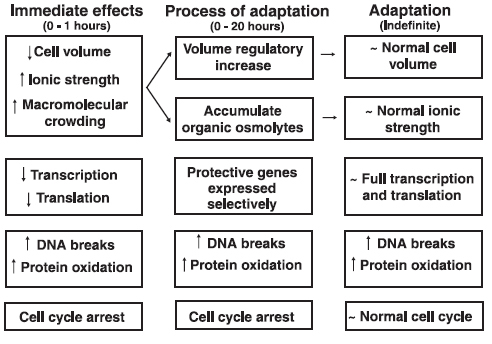
5. ábra. Ozmotikus stressz – adaptáció sejtszintű folyamatai. Burg, M. B., J. D. Ferraris, et al. (2007). "Cellular response to hyperosmotic stresses." Physiol Rev 87(4): 1441-74.
Az eddigieket figyelembe véve felmerülhet a kérdés hogyan képesek a sejtek saját térfogatuk változásának érzékelésére? A térfogat-szenzáció molekuláris sejtbiológiájának még nem minden lépése tisztázott, de az ozmotikus és térfogat paraméterek mindössze 3%-os változásai már kiváltják a korrekciós mechanizmusokat. A térfogatváltozás potenciális szenzorai közt szerepel a makromolekula csoportosulás, az ioneloszlás nagymértékű és gyors megváltozása, a citoszkeletális diszlokáció és a membrántenzió változása is. A sejttérfogat megváltozásának membránproteinek által közvetített direkt vagy indirekt érzékelését foglalja össze a 6. ábra.

6. ábra. Sejttérfogat változás detektálása membránproteinek segítségével. Hoffmann, E. K., I. H. Lambert, et al. (2009). "Physiology of cell volume regulation in vertebrates." Physiol Rev 89(1): 193-277.
A kék henger egy térfogat szenzitív proteint ábrázol, amely lehet egy membrán transzporter, egy receptor, vagy egy enzim is. A protein direkt aktivátora lehet annak közvetlen környezetében található membrán szegmens tenziós, vastagságbeli, elhajlási paramétereinek megváltozása. Az érzékelés megvalósulhat a proteinhez kapcsolódó citoszkeletális elemek révén is. A foszfolipid kinázok és foszfolipázok ozmoszenzitivitásának hatására bekövetkező membrán elhajlás indirekt protein aktivációt okoz. Végül a proteint aktiválhatja a térfogat szenzitív poszttranszlációs modifikáció és/vagy a membránba történő inszerció/eltávolítás. A sejtmembránnal kapcsolatos mechanikai paraméterekről és annak szenzoros folyamatairól részletesen szóltunk a sejtszintű mechanoszenzáció fejezetében. Szintén ott ismertük meg a citoszkeleton mechanoszenzációban betöltött szerepét is. A sejttérfogat változások szignalizációjának egyik nyilvánvaló szereplője a citoszkeleton. Jelenleg az intermedier filamentumok és mikrotubulusok ez irányú funkciójáról kevés és ellentmondásos adatok állnak rendelkezésre, így a fejezetben az aktin citoszkeleton reorganizációját elemezzük.

7. ábra. Sejtzsugorodást követő citoszkeleton reorganizáció sémája. LIMK: LIM kináz, PAK: p21 aktivált kináz, WASP: Wiscott-Aldrich protein Hoffmann, E. K., I. H. Lambert, et al. (2009). "Physiology of cell volume regulation in vertebrates." Physiol Rev 89(1): 193-277.
Mivel az aktin polimerizáció limitáló faktora a monomerek nukleációja, a sejtben található polimerizált aktin koncentrációjának megváltozása alapvető változásokat indukálhat a de novo nukleációban (Arp2/3 nukleációs faktorok) és az F-aktin darabolásában is (cofilin, gelsolin). Az ábrán az ozmotikus zsugorádás által kiváltott kortikális aktin citoszkeleton rendszer átlakulásának szignalizációja követhető. A szaggatott vonalak a még nem bizonyított, de valószínűsíthető útvonalakat jelzik.