A transz-Golgi ciszterna érési folyamata végén a rendkívül dinamikus képet mutató transz-Golgi hálózattá fejlődik. Elektronmikroszkópos képeken jól látszik, hogy ahogyan a CGN a cisz Golgi-ciszternával, úgy a TGN is - tubuláris csatornák által - összeköttetésben van a transz-Golgi ciszternával. A TGN a Golgi-készülék utolsó kompartmentje, amelyben még zajlik módosítás is (például a cukorláncok szulfatálása), de legfontosabb funkciója a szortírozás. A szekréciós út ezen állomásáig valamennyi molekula együtt szállítódik, a TGN feladata, hogy megkülönböztesse és a megfelelő végállomás – a plazmamembrán vagy a lizoszóma - felé indítsa el őket. A plazmamembrán felé is kétféle módon juthatnak: konstitutív (folyamatos) vagy szabályozott szekrécióval (10. ábra).
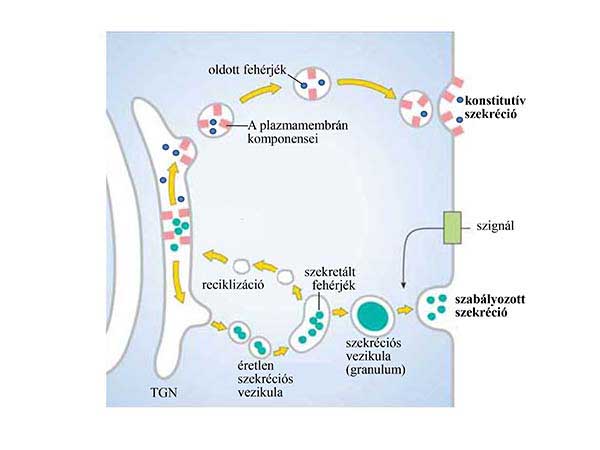
10. ábra A konstitutív és a szabályozott szekréció. A valamennyi sejttípusra jellemző folyamatos (konstitutív szekréció) pótolja a plazmamembrán és az extracelluláris tér komponenseit. A csak erre specializálódott sejtekben zajló szabályozott szekrécióval adott jelre, egyszerre ürülnek a kiválasztott fehérjét tartalmazó szekréciós vezikulák. A szekréciós vezikulák érési folyamaton mennek keresztül, amelyet fúzió, reciklizáció és a beltartalom nagyfokú koncentrálódása jellemez.
A ciszterna-érési modell alapján a TGN állománya tulajdonképpen eltűnik, megszűnik, membránja és lumene anterográd és retrográd irányba haladó (COPI-burkos) vezikulákra osztódik szét, és helyébe fokozatosan a transz-Golgi ciszterna lép.
A plazmamembrán felé irányított molekulákat tartalmazó vezikulák a legtöbb sejttípus esetében folyamatosan fűződnek le a TGN területéről és a dokkolás után exocitózissal juttatják tartalmukat az extracelluláris térbe vagy a membránba. Ilyen módon történik a sejtközötti állomány komponenseinek, valamint a membrán fehérjéinek és lipidtartalmának utánpótlása. Ez a konstitutív szekréció folyamata, amely valamennyi sejtben állandóan működik.
A konstitutív szekréció vezikuláinak képződéséről keveset tudunk. Nem azonosítottak eddig specifikus burokfehérjéket felszínükön, alakjuk és méretük változatos lehet. A konstitutív szekrécióra szánt fehérjék a TGN-beli osztályozáshoz alapesetben nem igényelnek külön jelet: ez az alapértelmezett útvonal. Ha például egy citoszolikus fehérjét mesterségesen az ER-be irányító szignállal látnak el, de egyéb jelet nem kap, folyamatosan fog az extracelluláris térbe ürülni.
A vezikulák plazmamembrán felé tartó célirányos mozgását a mikrotubulus-hálózat biztosítja. Interfázisos sejtben a centriólum által organizált mikrotubulusok (+)-vége van a sejthártya közelében, a transzportot tehát a (+)-vég felé haladó kinezin motorfehérjék végzik, a vezikula specifikus adapterfehérjéihez kötődve.
Speciális azonban a polarizált sejtek helyzete: ebben az esetben nem mindegy, hogy a szekréció az apikális vagy a bazolaterális felszín felé történik-e. Egy hámsejtnek például fejlett glikokalixra és nyálkatermelésre az apikális felszínen van szüksége, a bazolaterális irányba viszont a bazális membrán fehérjéit kell szekretálnia. A sejthártya komponenseinek pótlását is irányítani kell, hiszen a két membránterület összetételében és - ennek következtében – funkciójában jelentősen eltér. Szeparálásukban a szoros sejtkapcsoló struktúra (lásd 17. fejezet) játszik szerepet, de ez nem sokat érne, ha a membrán anyagainak megújulása nem biztosítaná a különbségek fenntartását.
A különböző felszínek felé irányuló szekréció több módon is megoldható. A hámsejtek esetében az jellemző, hogy a TGN-ben külön vezikulákban szállítódnak az apikális, illetve a bazolaterális felszín molekulái (11. ábra).
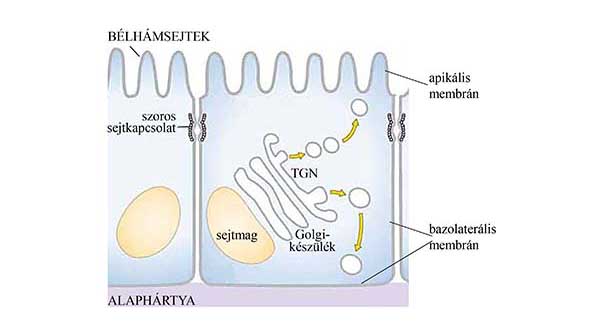
11. ábra Szekréció polarizált sejtekben. A szoros sejtkapcsoló struktúrák miatt a membránfehérjék laterális mozgása korlátozott, ezért a szeparált felszínekre külön kell megoldani a szállítást. A legtöbb esetben már a transz-Golgi hálózat (TGN) területén eldől, hogy a bazolaterális vagy az apikális felszínre kerülnek-e a transzportált anyagok.
A vezikulák membránjának összetétele eltér: más-más Rab GTP-ázok és v-SNARE-k találhatóak bennük – ez magyarázhatja a különböző célmembránokkal történő fúziót.
De hogyan válogatódnak maguk a szállított fehérjék az adott felszín felé induló vezikulákba? Univerzális jelet ebben az esetben sem sikerült azonosítani, valószínűleg több szerkezeti elem együttese szolgál komplex szignálként. Az azonban ismert, hogy az ER-ben GPI-horgonnyal ellátott fehérjék az esetek döntő többségében (kivételek is vannak!) az apikális membránba jutnak, de általában nem külön-külön. Sikerült olyan területeket kimutatni, amelyek azt igazolják, hogy a plazmamembrán apikális felszínén kitüntetett szerepet játszó lipid-tutajok már a TGN felszínén összeszerelődnek, és a GPI-fehérjék ezekbe lokalizálódnak. A lipid-tutajok emellett nagy arányban tartalmaznak glikoszfingolipideket, szfingomielint és koleszterint, valamint a speciális folyamatokban (például a jelátvitelben) együtt működő egyéb transzmembrán fehérjéket is „begyűjtik”. Teljes lipid-tutajok szegregálódnak és fűződnek le az apikális felszín felé tartó vezikulákba.
Egyes sejttípusoknál, például a hepatociták esetében más folyamat biztosítja az eltérő membrán-összetételt. Itt nincs válogatás a TGN szintjén, hanem valamennyi vezikula a bazolaterális felszínre ürít. A membrán azonban rögtön visszafűződik endocitózissal klatrin-burkos vezikulákba, és ezek azok az organellumok, amelyek szortíroznak: lefűződő vezikulákban a bazolaterális komponensek reciklizálódnak, míg az apikális komponensek átszállítódnak a sejt másik felszínére - ez a transzcitózis folyamata. A transzcitózis a többi polarizált sejtben is előfordul, valószínűleg korrekciós szereppel: a TGN válogatásában bekövetkezett hibákat hozza helyre. Az endocitózis folyamatát a 18. fejezet mutatja be.
A multicelluláris szervezetekre jellemző munkamegosztás fejlődése során igen korán elkülönültek azok a sejtek, amelyek valamilyen váladék termelésére szakosodtak. Ezek a kiválasztósejtek a folyamatos, valamennyi sejtféleségre jellemző szekréció mellett szabályozott ürítésre is képesek – speciális, általában nagy mennyiségben szintetizált termékük szekréciós vezikulákba csomagolva várakozik mindaddig, míg aztán valamilyen extracelluláris jel hatására ezek egyszerre fuzionálnak a plazmamembránnal. Itt hangsúlyozzuk, hogy szekréciós vezikuláknak vagy granulumoknak általában csak ezeket a nagyjából egyforma méretű és beltartalmú, nagyszámú, a kiválasztósejtekre jellemző képleteket nevezik.
Minden sejtre jellemző a szabályozott szekréció speciális esete, amelynek során a plazmamembrán felületének növelése céljából adott körülmények hatására (például az osztódó sejtek befűződése, a citokinézis során, vagy a plazmamembrán sérülésekor) egyszerre sok vezikula fúzionál, hogy a felszín növeléséhez szükséges plusz membránalkotókat biztosítsa.
Bár a szabályozott szekréciót végző sejtféleségek tanulmányozása vezetett a szekréciós út egyes folyamataival kapcsolatos mai ismereteinkhez, magáról a döntő lépésről, azaz a TGN-ben zajló szelekciós folyamatokról még mindig hiányosak az adatok. Nem tudják pontosan, hogy milyen burokfehérje segít a vezikulák lefűződésében: egyes elméletek szerint klatrinfehérjékről van szó, mások szerint a burok összetétele még ismeretlen.
Ugyanígy kevés adat áll rendelkezésre arról, hogy milyen szignál irányítja a TGN-ben a sokféle membrán-lefűződés közül éppen a leendő szekréciós vezikulába a váladékfehérjéket. Míg ezek a fehérjék a Golgi-készülék előző szakaszaiban a többi szállított anyaggal teljesen elvegyülnek, a TGN területén –a csökkenő pH-nak is köszönhetően - összecsapzódnak, és aggregátumaik kerülnek szelektíven, minden bizonnyal receptorok segítségével egy-egy vezikulába. Valószínű, hogy az aggregálódásban és a szelekcióban nem egyetlen szekvencia-részlethez köthető, hanem összetett, a fehérje felszínén foltszerűen érvényesülő jel játszik szerepet. Genetikailag módosított sejtekkel végzett kísérletek viszont azt igazolták, hogy ez az ismeretlen jel akár ugyanaz is lehet a különböző váladékfehérjék esetében: ha egy szekréciós sejtet mesterségesen egy rá egyébként nem jellemző hormon termeltetésére bírnak, az idegen hormon ugyanúgy aggregálódik és csomagolódik vezikulákba, mint a saját termék.
A szabályozott szekréciót végző sejtek sok esetben polarizáltak, bennük a szekretált molekula ürítése általában az apikális oldal irányába történik. Ide tartoznak az idegsejtek is, ahol az axon és az idegvégződések membránja számít apikális felszínnek. A konstitutív szekréció tárgyalásánál ismertetett okok miatt már legtöbbször a TGN területén eldől, hogy a lefűződő vezikula melyik felszín felé indul el.
A lefűződéskor keletkező membrán-határolta képlet neve éretlen szekréciós vezikula. Az érési folyamat első lépéseként azonnal megkezdődik a membrán reciklizációja a TGN irányába, amely a TGN-specifikus komponensek visszatérését biztosítja (10. ábra). A visszaszállító vezikula burkának összetétele itt sem tisztázott, egyes vizsgálatok szintén a klatrin szerepét vetik fel. Az érő vezikulák fúzionálnak is egymással, ez további membrán-reciklizációval jár. Ily módon csökken térfogatuk, beltartalmuk tovább koncentrálódik (12. ábra).
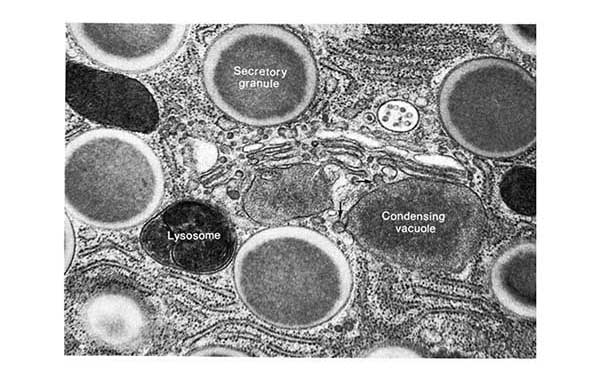
12. ábra Emlős (futóegér) fültőmirigy-sejtjének transzmissziós elektronmikroszkópos képe. A felvétel jobb felső részén durva felszínű endoplazmatikus retikulumot, középen a Golgi-készülék ciszternáit láthatjuk. Nyilak jeleznek két, a transz-Golgi-hálózatról lefűződött és egy nagyméretű, még éretlen szekréciós vezikulummal („condensing vacuole”) éppen fuzionáló vezikulát. Az érett szekréciós granulum („secretory granule”) felszíne lecsökkent, beltartalma viszont erősen kondenzált. Jól megkülönböztethető az erősen denz, és nem homogén beltartalmú lizoszómától („lysosome”).
Ez annak is köszönhető, hogy lumenük savasodik is, a membránban szelektíven dúsuló H+-pumpák működése révén. A pH fokozatos csökkenése egy másik, az érett szekréciós granulumokra jellemző folyamatban is szerepet játszik: ez a kiválasztott fehérjék proteolízise.
Sok szekretált hidrolitikus enzim, hormon és neurotranszmitter, valamint a membránfehérjék egy része a TGN elhagyása után az adott sejt szekréciós vezikuláira jellemző specifikus proteázok révén módosulhat. A proteolízis „időzítésében” segít a vezikulák fentebb említett fokozatos, enyhe savasodása, amely a proteázok aktivitásához szükséges. A hasítás bekövetkezhet a fehérje N-terminálisán, C-terminálisán, vagy a belsejében, akár több helyen is, gyakran úgynevezett dibázikus (argininből és/vagy lizinből álló) aminosav-pár mellett. Az ily módon processzált szekréciós fehérjék esetében az mRNS-ben kódolt teljes aminosav-szekvenciát szokás pre-proproteinnek, az ER szignál-peptidáza által hasított, de még nem érett fehérjét pedig proproteinnek (például: proinzulin) nevezni.
A proteolízis következménye lehet aktiválódás. A bontó enzimek esetében ennek a lépésnek - sokszor nem is a szekréciós vezikulákban, hanem csak az extracelluláris térben bekövetkező – késleltetése azt a célt szolgálja, hogy a sejt elkerülje saját alkotóelemeinek hidrolízisét. Más esetekben a proprotein sokkal stabilabb szerkezetű, ezért történik csak közvetlenül az exocitózis előtt az aktiválás.
Néha a később levágódó szekvencia ahhoz szükséges, hogy a fehérje végigjárhassa a szekréciós utat. A kis molekulasúlyú peptidhormonok, neuropeptidek érett formájukban sokszor olyan rövid aminosavláncból épülnek fel, hogy nem tudnának kotranszlációs transzlokációval az ER-be jutni, vagy a TGN-beli szelekcióhoz szükséges szignált biztosítani.
Egyes esetekben az eredeti géntermék nem is egy, hanem több érett peptid szintézisét biztosítja. Az ilyen, úgynevezett poliproteinek tartalmazhatják ugyanazt a fehérje-szekvenciát több kópiában, vagy több különböző peptiddé vágódhatnak szét. Sokszor ugyanaz a poliprotein különböző sejtekben más proteázokkal találkozik, ezért eltérő módon hasítódik. Jó példa erre a pro-opiomelanokortin alternatív processzálása az agyalapi mirigy egyes területein.
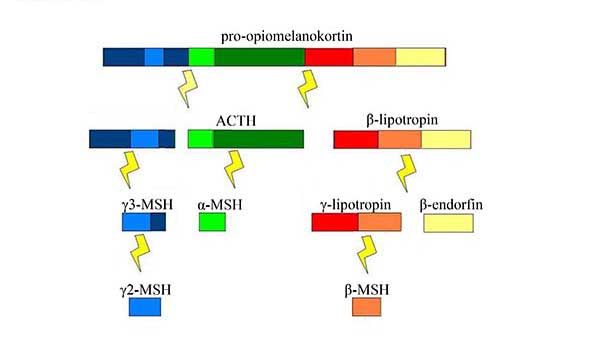
13. ábra Pro-opiomielokortin eltérő processzálásával különböző aktív hormonokat lehet előállítani. Az agyalapi mirigy különböző sejtjeiben más-más kombinációban találhatók a különböző proteázok (sárga „villám”), ezért szekréciós vezikulumaikban különböző hormonok képződnek és szabadulnak fel az exocitózis során.
A konstitutív szekrécióhoz hasonlóan a szekréciós granulumok is a mikrotubulus-váz mentén haladnak a plazmamembrán irányába. A megérkezés után azonban mindaddig nem következik be a fúzió, amíg egy adott intracelluláris jel erre nem ad utasítást. A jelet általában a sejt felszínén bekövetkező ligand-receptor kölcsönhatás váltja ki, vagy - ahogyan az idegsejtek esetében – membrán-depolarizáció. Az idegsejtek szabályozott szekréciója messze a legismertebb valamennyi közül, a továbbiakban (nagy vonalakban) ezt ismertetjük. Részletesebb információkat az idegélettani tananyagok tartalmaznak.
A szabályozott szekréciós út eddig ismertetett lépései azokban az idegsejtekben játszódnak le, amelyek fehérjealapú váladékot, úgynevezett neuropeptidet (például valamilyen endorfint) ürítenek. A klasszikus neurotranszmitterek kisebb, az acetilkolin kivételével egyetlen aminosavból vagy származékából álló molekulák. Természetesen nem az ER-Golgi úton haladnak végig, hanem a citoszolban szintetizálódnak, és a TGN-ről lefűződő, úgynevezett szinaptikus vezikulákba transzporterek közvetítésével kerülnek bele. A szinaptikus vezikulákat morfológiailag is meg lehet különböztetni a „közönséges” szekréciós granulumtól: igen nagy számban képződnek, és egyformán kicsik, 40-50 μm átmérőjűek. Emiatt jól lehet biokémiai módszerekkel izolálni őket, egyes szinaptikus vezikula-típusok teljes membrán-összetétele ismert. A vezikulák maguk tehát a szekréciós úton jönnek létre, lefűződésük után tartalmazzák azokat a membránfúzióhoz szükséges fehérjéket (például Rab GTP-áz, v-SNARE, H+-pumpa), amelyek valamennyi szekréciós vezikulára jellemzőek. Ugyanakkor membránjuk tele van az adott idegsejt által szekretált neurotranszmittert protonra cserélő antiporterrel is. A szinaptikus vezikulák savas beltartalma tehát azt az energiát is biztosítja, amely ahhoz szükséges, hogy a neurotranszmittert a citoszolból a vezikulába H+ ion ellenében szállító fehérje működjön. Egyes idegsejtek mind neuropeptidet, mind valamilyen neurotranszmittert képesek üríteni. Ezekben a kevés, nagyobb és denzebb beltartalmú szekréciós vezikulákat jól meg lehet különböztetni a szinaptikus vezikuláktól, és exocitózisuk is külön szabályozás alatt áll. A továbbiakban a legjobban ismert szinaptikus vezikulák exocitózisát mutatjuk be.
Az idegsejt dendritjein vagy sejttestjén (tehát a bazolaterális részén) bekövetkező receptor-aktiválódások egyesült hatása az axondombon akciós potenciált generál, amely az preszinaptikus idegvégződések területén csoportosuló feszültség-függő Ca2+-csatornák kinyílásához vezet. A hirtelen lokálisan több nagyságrenddel megemelkedő intracelluláris Ca2+-koncentráció vezet a neurotranszmittert tartalmazó szinaptikus vezikulák exocitózisához (14. ábra).
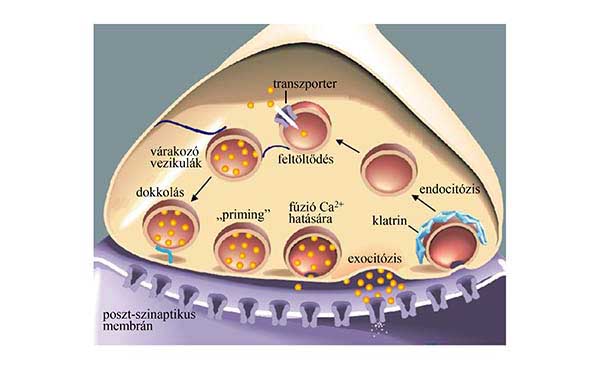
14. ábra Szabályozott szekréció idegsejtek axon-végződésein. Részletes magyarázat a szövegben olvasható, de kiemeljük a „priming” folyamatát, melynek során a szinaptikus vezikulák részlegesen kapcsolódnak a membránhoz, ezért a Ca2+-szint megemelkedése során igen gyorsan megtörténhet a teljes fúzió és a neurotranszmitter exocitózisa. A másik speciális folyamat a reciklizált „üres” vezikulák helyben való feltöltése a neurotranszmitterrel, amelyet a protonpumpák által kialakított H+-koncentráció-grádiens biztosít.
Ez a folyamat azonban a vezikulák dokkolásához, az idegsejt-specifikus v-SNARE/t-SNARE komplex kialakulásához és a lipid kettősréteg fúziójához szükséges időtartamnál jóval gyorsabban lezajlik (a membránfúzióhoz vezető lépések molekuláris mechanizmusát a 8. fejezet mutatja be). A szinaptikus vezikulák egy kis hányada ugyanis már egy részlegesen össszeszerelődött transz-SNARE-komplexen keresztül a preszinaptikus membránhoz kapcsolódik (ezt a folyamatot hívják angolul „priming”-nak). A komplex négy α–hélixének teljes feltekeredését olyan fehérjék akadályozzák meg, amelyek Ca2+ hatására konformációt váltanak, leválnak a transz-SNARE-komplexről és nem gátolják többé, esetleg más módon még segítik is a fúziót.
Egy idegsejt axonvégződésén másodpercenként akár több százszor is bekövetkezhet exocitózis. Ez egyrészt annak is köszönhető, hogy a szinaptikus vezikulák nagyon nagy mennyiségben várakoznak a preszinaptikus membrán úgynevezett aktivációs zónájában, de mindig csak kis számban dokkolódnak közvetlenül a membránnál. Amint egy adagnyi neurotranszmitter felszabadult a szinaptikus résben, a következő adag vezikula máris dokkol és készen áll egy újabb fúzióra.
A szinaptikus vezikulák másik jellegzetessége, hogy döntő többségük a gyors utánpótlás érdekében nem teszi meg a sejttestben lokalizálódó Golgi-készüléktől az axonon végigvezető, időnként igen hosszú utat a szinapszisig. A vezikulák folyamatos endocitózissal jutnak vissza, míg a szinaptikus résből a nem kötődött hírvivők transzporterek segítségével reciklizálódnak a citoszolba. Az először szinte még üres vezikulák a hagyományos endocitotikus úttal szemben (lásd 18. fejezet)- nem egyesülnek korai endoszómával, hanem a H+-pumpák révén a lumenükben felhalmozódó protonok koncentráció-grádiensét kihasználva a H+/neurotranszmitter antiporterek által helyben „feltöltődnek” (14. ábra). Így a hagyományos szekréciós út tulajdonképpen csak pótolja az elkerülhetetlenül apadó membrán- és neurotranszmitter-molekulákat, de a hatékony újrahasznosítás következtében a szinaptikus vezikulák többsége helyben, a preszinaptikus membrán közelében képződik.
Szinaptikus vezikula ()animáció