Az ubiquitin-proteaszóma rendszer (UPR) az eukarióta sejtek evolúciósan egyik legkonzervetívabb funkcionális rendszere. Működése végigkíséri a sejt egyedi életének egész időszakát a „születés” pillanatától az aktív sejthalálig. Zavartalan funkciója nem csak a sejt protein homeosztázisának biztosításában, a szabályozó fehérjék gyors turnoverében és a káros/kórós fehérjék szelektív eliminációjában nélkülözhetetlen, hanem az olyan folyamatokban is, mint a transzkripció, az irányított intracelluláris transzport, a sejtciklus, vagy az apoptózis. Nem véletlen tehát, hogy az UPR molekuláris komponenseinek felfedezéséért és alapvető funkcionális leírásukért 2004-ben három kutató is Nobel-díjat kapott, köztük a karcagi születésű Avram Herschko (Herschko Ferenc).
Az ubiquitiniláció a polipeptidek poszt-transzlációs módosításának egyik leggyakrabban előforduló típusa, amely – más PTM formákkal finoman összehangolt együttműködésben – számos komplex sejtélettani mehanizmus (például a sejtciklus) szabályozásáért felelős.
A célfehérjék szempontjából végzetes, ha egy lizin aminosavjuk 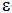 -helyzetű aminocsoportjához egy legalább 4 tagból álló poliubikvitin lánc kapcsolódik. Ez egyértelműen az adott fehérje proteaszómális lebontásra való megjelölését jelenti. Az ATP igényes mechanizmust egy 3 komponensű (E1, E2, E3) enzimkaszkád végzi (5. ábra).
-helyzetű aminocsoportjához egy legalább 4 tagból álló poliubikvitin lánc kapcsolódik. Ez egyértelműen az adott fehérje proteaszómális lebontásra való megjelölését jelenti. Az ATP igényes mechanizmust egy 3 komponensű (E1, E2, E3) enzimkaszkád végzi (5. ábra).
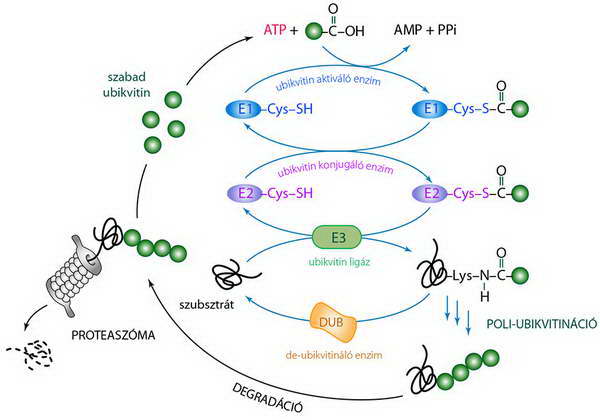
5. ábra. A poliubikvitiniláció a fehérjék proteaszómális degradációjához vezet: az ubikvitin molekulát első lépésben aktiválni kell (ezt az E1 enzim végzi), majd az aktivált ubikvitin E2 enzimre kerül. A megjelölendő fehérjét az E3 enzim ismeri fel, amely az E2 által biztosított, megfelelő állapotban lévő ubikvitint a célfehérjéhez kapcsolja. Ezután ehhez az első ubikvitin molekulához még több kapcsolódik (kis kék nyilak), s egy poliubikvitin lánc jön létre, amely a fehérjét a hidrolitikus aktivitású proteaszómához irányítja. A felszabaduló, visszanyert ubikvitin reciklizálódik
A fehérjeláncban található, Lysin oldalláncok ubikvitinilálása többféleképpen is megtörténhet. Monoubikvitiniláció az, amikor a fehérjén csak egy Lysin jelölődik, ráadásul csak egy ubikvitinnel. Ezt az E2 enzim is képes elvégezni. A multiubikvitiniláció során a lánc több ponton monoubikvitinálódhat, a poliubikvitiniláció esetében pedig egy olyan hosszabb ubikvitin lánc jön létre, amelynek csak az első tagja kapcsolódik a fehérjéhez (6. ábra).

6. ábra. Az ubikvitiniláció típusai (magyarázatot l. a szövegben)
A többféle ubikvitiniláció más és más szabályozási lehetőséget kínál (7. ábra).
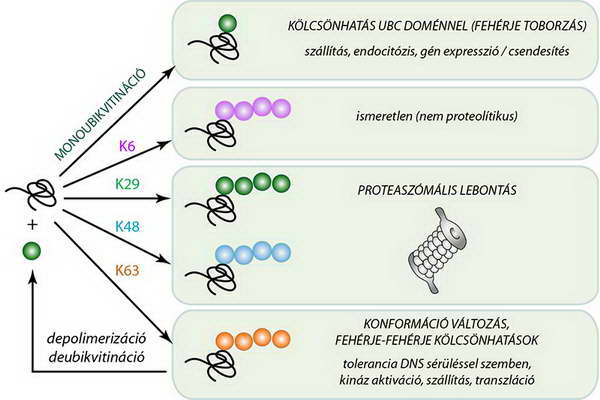
7. ábra.Az ubikvitiniláció típusából és helyzetéből adódó funkcionális különbségek (K6, K29, K48, K63: az ubkvitin molekula adott számú lizinjének ubikvitinilációját jelenti.)