A mitokondrium körülbelül 1500 fehérjét tartalmaz, amelyekből a mitokondriális DNS mindössze 13 fehérjét kódol. Ezek mindegyike az oxidatív foszforiláció enzimkészletéhez tartozik és a belső membránhoz kapcsolt formában funkcionál. A fennmaradó fehérjéket a nukleáris DNS kódolja. A mitokondriális DNS kezeléséhez szükésges enzimkészlet (replikáció, transzkripció, stb) szintén a sejtmagi DNS terméke. A korrekt funkció elérésehez a két sejtalkotó közti hatékony chaperon és transzlokációs komplex rendszerre van szükség. A TOM és TIM komplexen importált fehérjék minőségellenőrzését ún. mátrix rezidens proteinek végzik, mint pl. a HSP60 és HSP70. Ezek aktivitása és koncentrációja egyenesen arányos a stressz-stimulus intenzitásával.
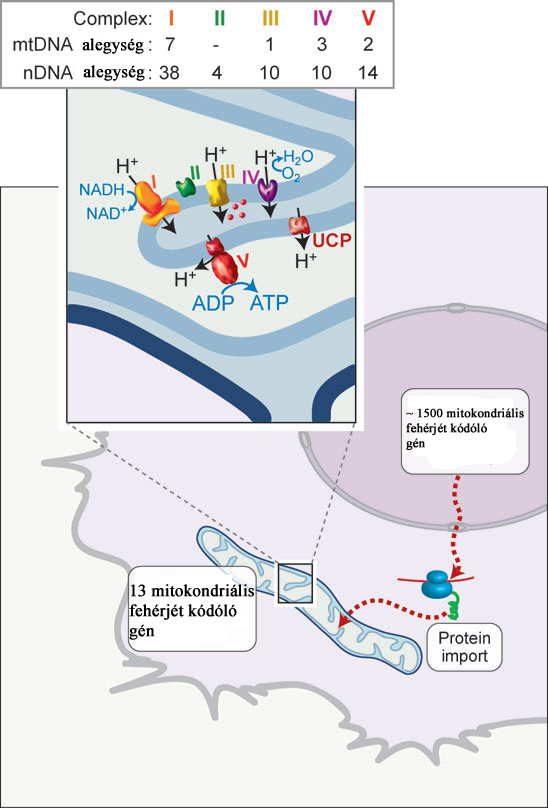
16. ábra. Nucleus és mitokondrium közti kommunikáció. Ryan, M. T. and N. J. Hoogenraad (2007). "Mitochondrial-nuclear communications." Annu Rev Biochem 76: 701-22.
Ebben a többszörösen szabályozott, komplex rendszerben bármely ponton bekövetkező kommunikációs zavar vagy mutáció az információáramlás akadályozását váltja ki, amely a sejt számára súlyos következményekkel járhat. A rendszer legérzékenyebb pontjai a Ca2+ koncentráció érzékelése, a fehérjeszintézis lépései és az elkészült fehérjék kompartmenteken keresztüli átlépése. A mitokondrium funkciójában keletkezett bármilyen kismértékű zavar a nukleáris génexpresszió széleskörű változását eredményezi a két organellum közti ún. retrográd szignalizáció révén.
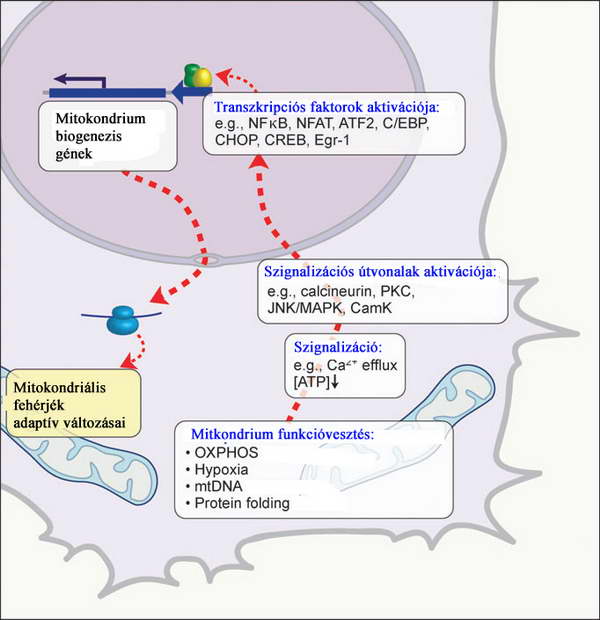
17. ábra. Mitokondrium-stressz szignalizációja Ryan, M. T. and N. J. Hoogenraad (2007). "Mitochondrial-nuclear communications." Annu Rev Biochem 76: 701-22.
Az ábráról is leolvasható mitokondriális funkció defektusok tulajdonképpen a mitokondriális membránpotenciál csökkenéséhez és ATP produkció csökkenéséhez vezetnek, amelyek a MSR tipikus jelei. Az MSR-t leggyakrabban a hipoxia, mitokondriális DNS mutációja, protein folding hibák, illetve az oxidatív foszforilációs apparátus tartós funkcióvesztése indukálja. A citoplazmában az ion efflux miatt emelkedik a szabad Ca2+ koncentrációja. Ez a jelenség szignalizációs fehérjéket aktivál, amelyek nukleáris transzkripciós faktorok aktivitását irányítják. A sejtmagban így bekapcsolt fehérjék végrehajtják a mitokondriális regenerációt. A mitokondriális mátrixban felszaporodott unfolded proteinek váltják ki a mitokondriális UPR-t, amely független a jól ismert ER UPR-től (lásd a következő fejezetet). A 18. ábrán felvázolt emlős mitokondriális UPR egy kétlépcsős folyamat.
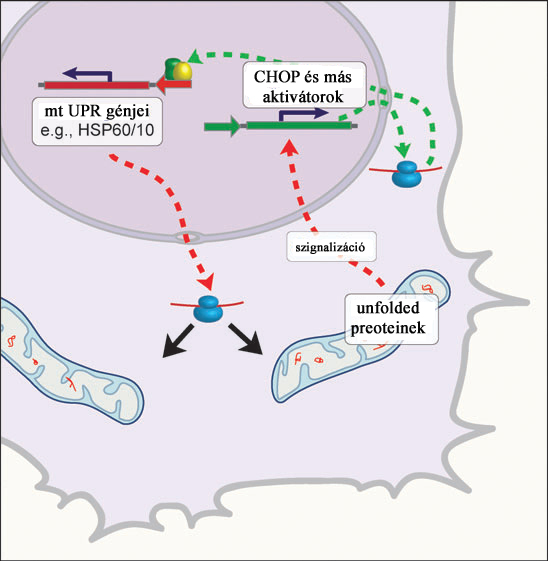
18. ábra. Mitokondrium és UPR. Ryan, M. T. and N. J. Hoogenraad (2007). "Mitochondrial-nuclear communications." Annu Rev Biochem 76: 701-22.
A mitokondrium egy eddig még nem meghatározott szignalizációs komponens segítségével jelzést küld a sejtmagba, ahol ez a folyamat a CHOP gén aktiválódását eredményezi. Ezt követően a CHOP más transzkripciós faktorokkal dimerizál (pl a C/EBP: citidin-adenozin-timidin motivum enhancer-binding protein) és a mitokondriális UPR génjeit aktiválja (pl. HSP60, HSP70, molekuláris chaperonok, proteázok, stb.). Meg kell említenünk, hogy a CHOP-nak csak a C/EBP-transzkripciós faktorral alkotott komplexe képes kiváltani a génexpressziós változásokat; ezért a folyamatot szokták CHOP-C/EBP szignalizációnak is nevezni.