Saccharomyces cerevisiae élesztőgombában figyelték meg, hogy mitokondriális defektust követően módosul a nukleáris génexpresszió. Az élesztők képesek az anyagcseréjüket az oxigén-koncentráció függvényében aerob, illetve fermentatív útvonalra irányítani, így esetükben a mitokondriális funkció részleges vagy teljes kiesése nem az ATP-utánpótlás kimaradását jelenti, mint egy kizárólag aerob metabolizmussal működő sejtben. Az élesztőben a mitokondrium károsodása a sejt számára elsősorban glutaminsav (glutamát)-hiányt jelent, mert van két pont, ahol a mitokondriális elektron-transzport és a citrát-ciklus összekapcsolódik: 1/a NADH (I. komplex) és 2/ az ubikinon (II. komplex). Az ubikinon egy kinon-szerkezetű elektron-akceptor, amely két elektron és két proton felvételére és továbbadására képes. Az ubikinonhoz csatlakoznak a citrát ciklusban a borostyánkősav (szukcinát) dehidrogenzéséből keletkezett H-atomok. Ha tehát az elektrontranszport-lánc gátolt, akkor egyrészt a NADH-ból nem érkeznek elektronok és protonok a mitokondriumhoz, másrészt a szukcinátból érkező H-ek nem tudnak becsatlakozni az elektrontranszport-láncba, tehát a citrát-ciklus is le fog állni. Ha viszont leáll a citrát-ciklus, akkor nem termelődik glutaminsav, és ez az élesztő számára a fő probléma. A glutaminsav (Glu) ugyanis az az aminosav, amely központi helyet foglal el a többi N-tartalmú aminosav bioszintézisében. Emiatt az élesztőben a mitokondrális defektust követően a sejtmagban azon gének expressziója indul be, amelyek a mitokondriumban helyreállítják a glutamát-szintézist. A Glu bioszintézisének kulcsmolekulája az α-keto-glutársav (αKG), tehát kézenfekvő, hogy Glu-hiány esetén többek között aktiválódnak az αKG-t előállító mechanizmusok. Ha több αKG-ra van szükség, akkor a sejt többfrontos kűzdelmet indít ennek az érdekében: egyrészt up-regulálja mindazokat a mitokondriális enzimeket, amelyek az αKG-szintet növelik, másrészt elősegíti a prekurzorok (pl. citrát) termelődését a peroxiszómában és transzportját a mitokondriumba, harmadrészt stimulálja az elkészült αKG kijutását a citoplazmába. Mindezek alapján könnyen felvázolhatjuk, hogy melyek azok a gének, amelyek up-regulálódnak a mitokondriális defektust követő retrográd szignalizáció során: 1/ az αKG citrát-ciklusban történő termelődését irányító gének (citrát szintáz (CIT), akonitáz (AKO), és izocitrát dehidrogenáz (IDH), amelyek termékei három lépésben alakítják át az oxálecetsavat αKG-vá, 2/ a peroxiszómában termelődött citrát MK-ba történő transzportjáért felelős citrát transzfer protein génje (CTP), és 3/ az αKG-at a mitokondriumból a citoplazmába átjuttató transzporter génje (oxidikarbonsav transzporter: ODC). Emellett up-regulálódik a piruvát karboxiláz is, amely a piruvátot nem acetil-CoA-vá alakítja át (ami a piruvát dehidrogenáz működésének eredménye), hanem közvetlenül oxálecetsavvá, ami beléphet a citrátkörbe és további αKG molekulák prekurzora lehet. A citoplazmába kijutott αKG-ból a glutamát dehidrogenáz, vagy glutamin felhasználásával a glutamát szintáz készíti el a hőn áhított glutamátot.
A retrográd szignalizáció génjei (RTG) három fehérjét kódolnak (Rtg1, Rtg2 és Rtg3), amelyek részint foszforilácós mechanizmussal, részint fehérje-fehérje kölcsönhatáson keresztül juttatják el a szignált a sejtmagba.
3.ábra
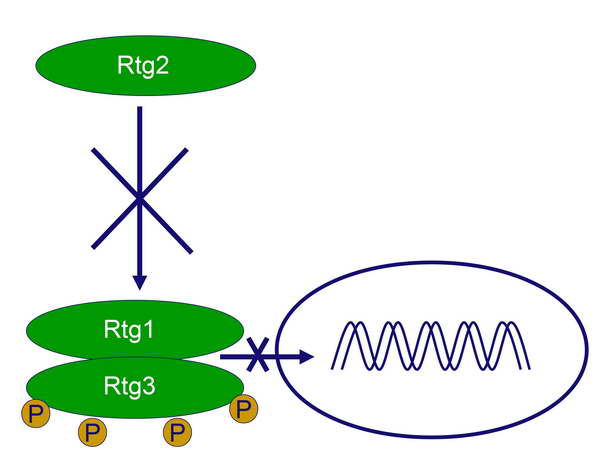
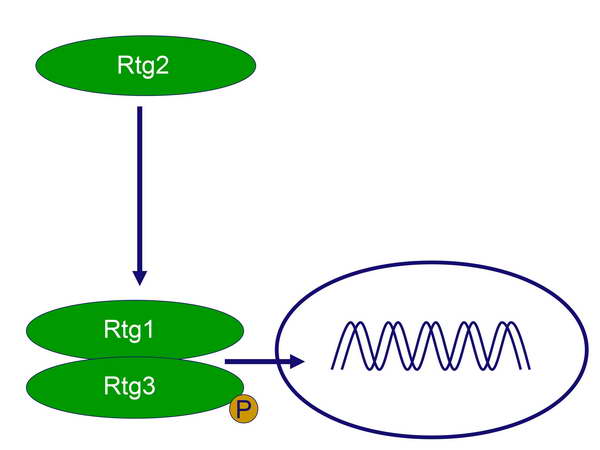
Közülük az Rtg1 és Rtg3 játszik effektor szerepet, mivel transzkripciós faktorok, amelyek megfelelő stimulusra belépnek a sejtmagba és elindítják a CIT1 gén átírását,
4. ábra
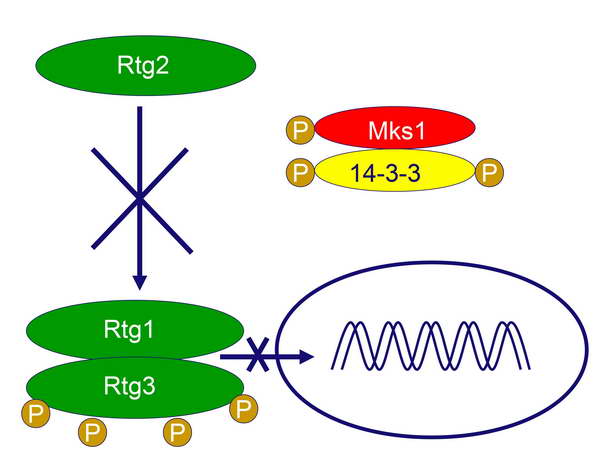
míg az Rtg2 a szignalizációs lánc egyik korábbi komponense. Alapállapotban (RTG szignalizáció kikapcsolva) az Rtg1 és Rtg3 transzkripciós faktorok dimerizálódva „szunnyadnak” a citoplazmában, méghozzá úgy, hogy az Rtg3 jelentős mértékben foszforilálódva van (3 vagy 4 P-csoport). Ugyanekkor, ha az SPS aminosav-szenzor normális glutamát-szintet érzékel, gátolja az Rtg2 „főkapcsolót” (5. ábra).
5. ábra
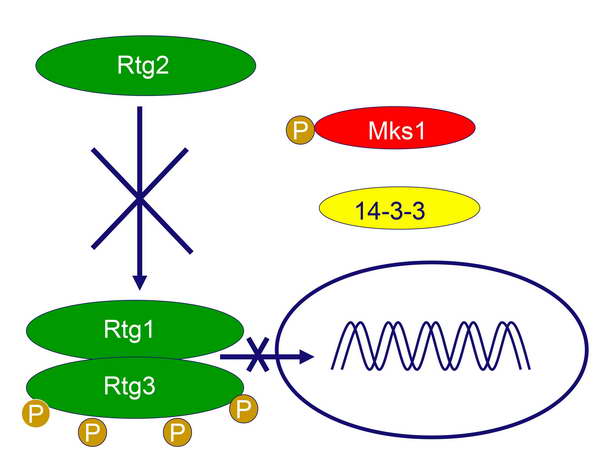
A rendszer akkor lép működésbe, amikor a citoplazmában kószáló SPS észleli a glutamát-hiányt, és emiatt kevésbé fogja gátolni (azaz aktiválni fogja) az Rtg2 fehérjét. Az Rtg2 tehát működésbe lép, azaz megteszi a lépéseket az Rtg1 és Rtg3 aktiválására. Ehhez azonban még arra is szükség van, hogy a retrográd szignalizáció egyik negatív regulátorát, az Mks1 fehérjét magához kösse. Ez a foszforilált fehérje ugyanis normál körülmények között egy duplán foszforilált 14-3-3 fehérjéhez kötődik, amely interakció megakadályozza az Rtg1-Rtg3 dimer aktiválódását (5. ábra). A retrográd szignalizáció első lépésében egy foszfatáz aktiválódik, amely lehasítja a 14-3-3 fehérje P-csoportjait, amiatt az „elengedi” a hozzá asszociálódott Mks1 fehérjét, és egyszersmind felfüggeszti az Rtg1-Rtg3 dimer gátlását (6. ábra).
6. ábra
Az aktiv Rtg2 kapcsolódik a szabaddá vált Mks1 fehérjéhez (kivonja őt a forgalomból), és ezzel megnyílik az út az Rtg1-Rtg3 dimer aktiválásához (7. ábra).
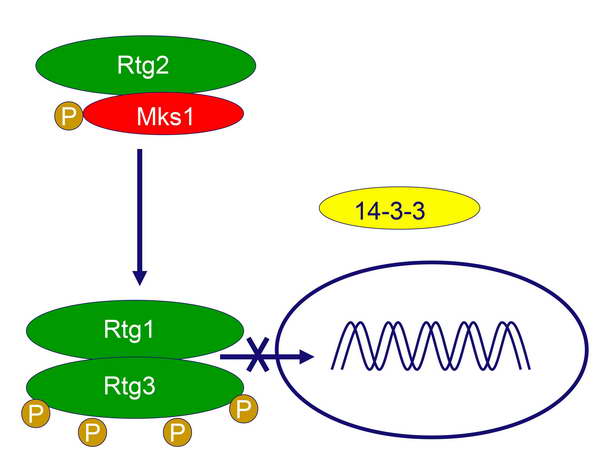
7. ábra
Az aktiváció során további foszfatázok aktiválódnak, amelyek defoszforilálják az Rtg3-at, így az egész Rtg1-Rtg3 dimer be tud kerülni a sejtmagba és ki tudja fejteni a transzkripciós faktor működését, azaz indukálni képes a retrográd válaszban szereplő effektor géneket (8. ábra).
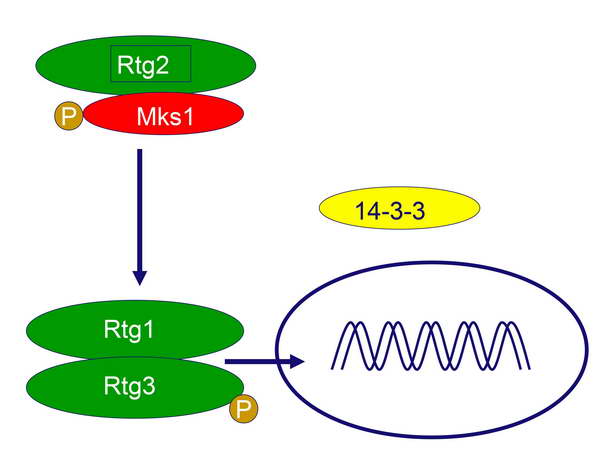
8. ábra
Az Rtg szignalizációs kaszkád működése élesztőben